
【題目】在一定溫度下的恒容容器中,對可逆反應2SO2(g)+O2(g)![]() 2SO3(g),下列敘述中,能說明反應已達到化學平衡狀態的是( )
2SO3(g),下列敘述中,能說明反應已達到化學平衡狀態的是( )
①單位時間內斷裂a mol O=O鍵,同時生成2a mol SO3②SO2生成的速率與SO3分解的速率相等③容器內的壓強不再變化④混合氣體的物質的量不再變化⑤混合氣體的平均相對分子質量不再變化⑥混合氣體的密度不再變化
A. ②③④B. ②④⑥C. ③④⑤D. ①②④
【答案】C
【解析】
可逆反應達到平衡狀態時,正逆反應速率相等,反應體系中各物質的物質的量、物質的量濃度、百分含量以及由此引起的一系列物理量不變,據此分析解答.
①單位時間內斷裂a mol O=O鍵,同時生成2a mol SO3,均體現正反應速率,則無法確定達到平衡狀態,故①錯誤;②SO2生成的速率與SO3分解的速率,均為逆反應速率相等,無法判斷反應達到平衡狀態,故②錯誤;③容器內的壓強不再變化,說明混合氣體的總物質的量不再隨時間變化而變化,是平衡狀態,故③正確;④正反應是混合氣體總物質的量減小的方向,當混合氣體的物質的量不再變化,是平衡狀態,故④正確;⑤混合氣體的總質量不變,混合氣體的總物質的量不確定,當混合氣體的平均相對分子質量不再變化時,說明氣體總物質的量不再隨時間變化而變化,此時是平衡狀態,故⑤正確;⑥混合氣體的質量和氣體的體積始終一定,則混合氣體的密度不再變化,無法確定是平衡狀態,故⑥錯誤;③④⑤正確,故答案為C。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:
【題目】銅單質及其化合物在很多領域有重要用途,如金屬銅用來制造電線電纜,五水合硫酸銅可用作殺菌劑等。
(1)基態Cu2+的核外電子排布式為____________。
(2)科學家通過X射線推測膽礬中既含有配位鍵,又含有氫鍵,其結構示意圖可簡單表示如下:
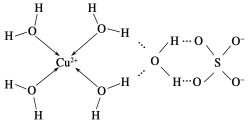
①膽礬的化學式用配合物的形式表示為____________。
②膽礬中SO42-的立體構型名稱為________,H2O的VSEPR模型名稱為____。
(3)向硫酸銅溶液中加入過量氨水,可生成[Cu(NH3)4]2+配離子。已知NF3與NH3的空間構型都是三角錐形,但NF3不易與Cu2+形成配離子,其原因是______________________。
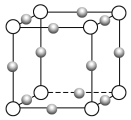
(4)Cu3N形成的晶體結構如下圖所示,N3-的配位數是______。設晶胞邊長為a cm,密度為b g/cm3,則阿伏加德羅常數可表示為______________(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室利用橄欖石尾礦(主要成分為MgO及少量FeO、Fe2O3、Al2O3等)制備純凈氯化鎂晶體(MgCl2·6H2O),實驗流程如下:

已知幾種金屬陽離子形成氫氧化物沉淀時的pH如下表

回答下列問題:
(1)“浸取”步驟中,能加快浸取速率的方法有______________________(任寫兩種)。
(2)氣體X的電子式為___________,濾渣1經過處理可以制得一種高效的無機高分子混凝劑、凈水劑,其化學式為[Fe2(OH)n(SO4)(3-0.5n)]m,則該物質中鐵元素的化合價為___________。
(3)加入H2O2的目的是___________;若將上述過程中的“H2O2”用“ NaClO”代替也能達到同樣目的,則發生反應的離子方程式為_________________________________。
(4)“一系列操作”主要包括加入足量鹽酸,然后經過______________________、過濾、洗滌,即得到氯化鎂晶體。
(5)準確稱取2.000g氯化鎂晶體產品于250mL錐形瓶中,加水50mL使其完全溶解,加入100mL氨性緩沖液和少量鉻黑T指示劑,溶液顯酒紅色,在不斷震蕩下,用0.5000mol·L-1的EDTA標準溶液進行滴定,其反應原理為Mg2++Y4-=MgY2-,滴定終點時消耗EDTA標準溶液的體積19.00mL。
①則產品中MgCl2·6H2O的質量分數為___________(結果保留3位有效數字)。
②下列滴定操作會導致測量結果偏高的是___________(填宇母)。
a.錐形瓶洗滌后沒有干燥 b.滴定時錐形瓶中有液體濺出
c滴定終點時俯視讀數 d滴定管滴定前有氣泡,滴定后氣泡消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)乙炔的電子式__________________。
(2)![]() 分子式:_________________。
分子式:_________________。
(3)![]() 其苯環上的一氯代物有______種
其苯環上的一氯代物有______種
(4)結構簡式為![]() 此烴名稱為___________________。
此烴名稱為___________________。
(5) 4,4,5﹣三甲基﹣2﹣己炔(寫出結構簡式) ____________。
(6)結構簡式為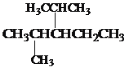 的烴可命名為:____________________。
的烴可命名為:____________________。
(7)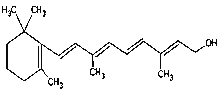 1mol該物質消耗_______molH2.
1mol該物質消耗_______molH2.
(8)鑒別苯,碘化鉀溶液,硝酸銀溶液,己烯,四氯化碳時,只能用一種試劑,該試劑是_________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將少量稀鹽酸滴加到盛有碳酸鈣的U形管中,可觀察到U形管中的脫脂棉劇烈燃燒。
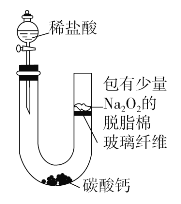
(1)稀鹽酸與碳酸鈣反應的離子方程式是__________________________
(2)從脫脂棉的燃燒可以推出Na2O2與CO2反應的結論是a.________________,b.________________。
(3)Na2O2與CO2反應的化學方程式是_________________________,還原劑是________,氧化劑是________。(填化學式)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室有一未知濃度的鹽酸,某同學在實驗室中進行實驗測定鹽酸的濃度。請完成下列填空:
配制100mL0.10molL-1NaOH標準溶液。需用托盤天平稱量___g的氫氧化鈉固體。
取20.00mL待測鹽酸放入錐形瓶中,并滴加 2~3滴酚酞作指示劑,用配制的標準 NaOH溶液進行滴定。重復上述滴定操作 2~3次,記錄數據如下:
滴定次數 | 待測鹽酸的體積/mL | 0.10 mol/L NaOH 溶液的體積/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①該實驗滴定達到終點的標志是_________
②根據上述數據,可計算出該鹽酸的濃度約為______。(保留兩位有效數字)
③在上述實驗中,下列操作(其他操作正確)會造成測定結果偏高的有_______。(雙選)
A 滴定終點讀數時俯視讀數 B 酸式滴定管使用前,水洗后未用待測鹽酸潤洗
C 錐形瓶水洗后未干燥 D 堿式滴定管尖嘴部分有氣泡,滴定后消失
E 稱量NaOH 固體時,混入少量KOH雜質
④現用以上實驗配制的0.10molL-1NaOH溶液滴定未知濃度的CHCOOH溶液,反應恰好完全時,下列敘述中正確的是_____
A 溶液呈中性,可選用甲基橙或酚酞作指示劑
B 溶液呈中性,只能選用石蕊作指示劑
C 溶液呈堿性,可選用甲基橙或酚酞作指示劑
D 溶液呈堿性,只能選用酚酞作指示劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水煤氣是重要燃料和化工原料,可用水蒸氣通過熾熱的碳層制得:C (s) +H2O(g)![]() CO(g) +H2(g) △H=+131.3kJmol-1
CO(g) +H2(g) △H=+131.3kJmol-1
(1)該反應的化學平衡常數表達式K=___,若某溫度下,K值的大小為0.5,此時向體積為1L的密閉容器中加入1mol H2O(g)和足量C(s),H2O(g)的平衡轉化率為___
(2)對于該反應,一定可以提高平衡體系中H2的百分含量,又能加快化學反應速率的措施是____。
a.升高溫度 b.增大水蒸氣的濃度 c.加入催化劑 d.降低壓強
(3)上述反應達到平衡后,移走體系中部分C(s),平衡_____,將產生的CO全部移走,平衡___(以上兩空選填“向左移”、“向右移”、“不移動”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能表示H2(g)+ I2(g)![]() 2HI(g)已經達到平衡狀態的標志是( )
2HI(g)已經達到平衡狀態的標志是( )
①c(H2)=c(I2)=c(HI)時
②c(H2):c(I2):c(HI)=1:1:2時
③c(H2)、c(I2)、c(HI)不再隨時間而改變
④單位時間內生成nmolH2的同時生成2nmolHI
⑤單位時間內生成nmolH2的同時生成nmolI2
⑥反應速v(H2)=v(I2)=1/2v(HI)
⑦一個H-H鍵斷裂的同時有兩個H-I鍵斷裂
⑧溫度和體積一定時,容器內壓強不再變化
⑨溫度和體積一定時,混合氣體的顏色不再變化
⑩溫度和壓強一定時,混合氣體的密度不再變化
條件一定,混合氣體的平均相對分子質量不再變化
A.③④⑦⑨⑩B.③④⑦⑨C.②③④⑦⑨D.②③④⑥⑦⑨
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組利用下圖裝置制取少量氯化鋁,已知氯化鋁熔沸點都很低(178℃升華),且易水解。下列說法中完全正確的一組是
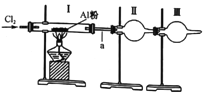
①氯氣中含的水蒸氣和氯化氫可通過盛有苛性鈉的干燥管除去
②裝置I中充滿黃綠色氣體后,再加熱盛有A鋁粉的硬質玻璃管
③裝置II是收集裝置,用于收集氯化鋁
④裝置III可盛放堿石灰也可盛放無水氯化鈣,二者的作用相同
⑤a處使用較粗的導氣管實驗時更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com