
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ;⑪
;⑪ .
. ;在一定條件下,若將元素①的單質和氫氣的混合氣體通入4L的密閉容器中發生反應,半分鐘后測得生成物的物質的量為1.4mol,則用元素①的單質表示的反應速率為0.35mol/(L•min).
;在一定條件下,若將元素①的單質和氫氣的混合氣體通入4L的密閉容器中發生反應,半分鐘后測得生成物的物質的量為1.4mol,則用元素①的單質表示的反應速率為0.35mol/(L•min). 分析 由元素在周期表中位置,可知①為N、②為F、③為Na、④為Mg、⑤為Al、⑥為Si、⑦S、⑧為Cl、⑨為Ar、⑩為K、⑪為Ca、⑫為Br.
(1)④、⑫分別為Mg、Br;
(2)⑤為Al、⑪為Ca,結合核外電子排布書寫原子結構示意圖;
(3)同周期從左向右元素的金屬性減弱,非金屬性增強,同主族從上到下元素的金屬性增強,非金屬性減弱;
(4)比較非金屬性強弱,可根據氫化物的穩定性或者對應的最高價氧化物的水化物的酸性強弱;
(5)第三周期中原子半徑最大的元素跟它同周期中原子半徑最小的元素形成的化合物為NaCl;
(6)現代光學及光纖制品的基本原料為二氧化硅;
(7)①為N,對應的氫化物為氨氣,結合v=$\frac{△c}{△t}$計算反應速率.
解答 解:由元素在周期表中位置,可知①為N、②為F、③為Na、④為Mg、⑤為Al、⑥為Si、⑦S、⑧為Cl、⑨為Ar、⑩為K、⑪為Ca、⑫為Br.
(1)由以上分析可知④、⑫分別為Mg、Br,故答案為:Mg; Br;
(2)⑤為Al,原子核外有3個 電子層,最外層電子數為3,原子結構示意圖為 ,⑪為Ca,原子核外有4個 電子層,最外層電子數為2,原子結構示意圖為
,⑪為Ca,原子核外有4個 電子層,最外層電子數為2,原子結構示意圖為 ,故答案為:
,故答案為: ;
; ;
;
(3)根據元素周期表性質的遞變規律,最活潑的金屬應在第IA,最活潑的非金屬應在第VIIA,惰性氣體最不活潑,則在IA元素Na(③)和K(⑩)中K最活潑;在VII元素Cl(⑧)和Br中,Cl最活潑;最不活潑的是⑨即Ar,
故答案為:K;F;Ar;
(4)元素⑦與元素⑧相比,非金屬性較強的是Cl,比較非金屬性強弱,可根據氫化物的穩定性或者對應的最高價氧化物的水化物的酸性強弱,聚集狀態屬于物理性質,與化學性質無關,與氫氧化鈉反應不能比較非金屬性強弱,
故答案為:Cl;b;
(5)第三周期中原子半徑最大的元素跟它同周期中原子半徑最小的元素形成的化合物為NaCl,為離子化合物,故答案為:離子;
(6)現代光學及光纖制品的基本原料為二氧化硅,化學式為SiO2,為共價化合物,含有共價鍵,故答案為:SiO2;共價;
(7)①為N,對應的氫化物為氨氣,電子式為 ,在一定條件下,若將元素①的單質和氫氣的混合氣體通入4L的密閉容器中發生反應,發生N2+3H2?2NH3,半分鐘后測得生成物的物質的量為1.4mol,則消耗0.7molN2,
,在一定條件下,若將元素①的單質和氫氣的混合氣體通入4L的密閉容器中發生反應,發生N2+3H2?2NH3,半分鐘后測得生成物的物質的量為1.4mol,則消耗0.7molN2,
v=$\frac{△c}{△t}$=$\frac{\frac{0.7mol}{4L}}{0.5min}$=0.35mol/(L•min),
故答案為: ;0.35mol/(L•min).
;0.35mol/(L•min).
點評 本題考查元素的位置、結構和性質的推斷,為高頻考點,側重于學生的分析能力的考查,題目難度不大,注意元素周期律的遞變規律等知識的積累.


 Happy holiday歡樂假期暑假作業廣東人民出版社系列答案
Happy holiday歡樂假期暑假作業廣東人民出版社系列答案 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案科目:高中化學 來源: 題型:選擇題
| A. | V(H2)=0.3 mol•L-1•min-1 | B. | V(NH3)=0.01 mol•L-1•s-1 | ||
| C. | V(N2)=0.2 mol•L-1•min-1 | D. | V(H2)=0.01 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的實驗式就是其分子式 | |
| B. | 質譜法可以測定物質的相對分子質量 | |
| C. | 從物質的紅外光譜圖可以獲得分子中含有化學鍵或官能團的信息 | |
| D. | 從核磁共振氫譜圖可以推知該有機物分子有幾種不同類型的氫原子及他們的數目之比 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在潮濕疏松透氣的土壤中 | B. | 在干燥致密不透氣的土壤中 | ||
| C. | 在含鐵元素較多的酸性土壤中 | D. | 在含碳粒較多,潮濕透氣的土壤中 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | S區的元素一定是主族元素 | B. | d區元素一定是副族元素 | ||
| C. | p區的元素一定是主族元素 | D. | ds區元素一定是副族元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;1mol O22+中含有的π鍵數目為2NA.
;1mol O22+中含有的π鍵數目為2NA.| 代號 | 結構簡式 | 水中溶解度/g(25℃) | 熔點/℃ | 沸點/℃ |
| X | 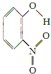 | 0.2 | 45 | 100 |
| Y | 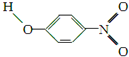 | 1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com