
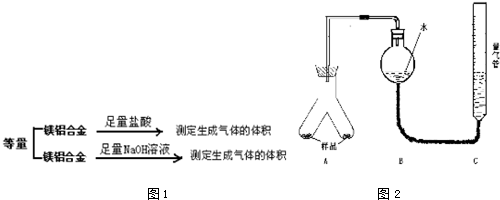
分析 (1)實驗目的是通過測量氣體體積計算合金中鎂的質量分數,所以必須確保裝置氣密性良好;可以向C中進入少量水,根據液面變化判斷裝置氣密性;
(2)合金是否完全溶解(或加入足量鹽酸,或調整量氣管C的高度,使C中液面與B液面相平,待冷卻至室溫再讀體積)等會影響測定結果;
(3)鎂、鋁都與稀硫酸反應,二者生成氫氣總體積為V2-V1,據此計算出氫氣的物質的量,然后分別根據合金質量、生成氫氣的量列式計算出二者的物質的量,再計算出鎂的質量及質量分數;
(4)鎂不與氫氧化鈉溶液反應,可以根據生成的氫氣計算出鋁的物質的量,再計算出鋁的質量分數,從而可以得出合金中鎂的質量分數,所以可以省略③.
解答 解:(1)分析流程和步驟可知,該實驗目的是通過測定氣體體積的方法測定合金質量分數,故裝置需要氣密性完好,應對裝置進行氣密性檢查,檢查方法為:向C中加入一定量水,然后提高C使其中液面高于B,靜置一會兒,若液面不發生變化則氣密性良好;
故答案為:檢查氣密性;向C中加入一定量水,然后提高C使其中液面高于B,靜置一會兒,若液面不發生變化則氣密性良好;
(2)為使該實驗方案測定結果盡可能準確,則必須保證合金完全溶解(或加入足量鹽酸),還要調整量氣管C的高度,使C中液面與B液面相平,待冷卻至室溫再讀體積等,
故答案為:合金完全溶解(或加入足量鹽酸,或調整量氣管C的高度,使C中液面與B液面相平,待冷卻至室溫再讀體積等合理答案);
(3)每份合金的質量a=0.30g,根據題中信息可知,進入足量稀硫酸后鎂、鋁都與稀硫酸反應,生成氫氣總體積為:448mL-112mL=336mL,生成氣體的物質的量為:$\frac{0.336L}{22.4L/mol}$=0.015mol,設鎂的物質的量為x、鋁的物質的量為y,則24x+27y=0.3、x+1.5y=0.015mol,解得:y=$\frac{0.02}{3}$mol、x=0.005mol,則合金中鎂的質量為:24g/mol×0.005mol=0.12g,則合金中鎂的質量分數為:$\frac{0.12g}{0.3g}$×100%=40%,
故答案為:40%;
(4)步驟④中的氫氣為鋁與氫氧化鈉溶液反應生成的,可以根據氫氣的體積計算出氫氣的物質的量,然后計算出鋁的物質的量、質量,從而得出合金中鎂的質量及質量分數,所以可省略③,
故答案為:合理,合金中只有鋁與氫氧化鈉溶液反應,可以根據④中生成的氫氣的量計算出鋁的量,從而計算出鎂的質量分數.
點評 本題考查了探究物質組成及含量的方法,題目難度中等,明確探究原理為解答關鍵,注意掌握常見的化學實驗基本操作方法,試題側重考查學生的分析、理解能力及化學實驗、化學計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氯化鋁溶液中加入過量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小蘇打治療胃酸過多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2與HI的反應:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如圖所示,其中X、Y、Z三種元素的質子數之和為21.回答下列問題
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如圖所示,其中X、Y、Z三種元素的質子數之和為21.回答下列問題| X | Y | Z | W |
| E | Q |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當n(Na)=n(Mg)=n(Al)=1mol時,①成立 | B. | 當n(Na)=n(Mg)=n(Al)=0.8mol時,②成立 | ||
| C. | 當n(Na)=n(Mg)=n(Al)=0.6mol時,③成立 | D. | 當n(Na)=n(Mg)=n(Al)=0.5mol時,④成立 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com