
分析 (1)FeCl3是強酸弱堿鹽,加熱過程中發生水解生成Fe(OH)3和HCl,HCl具有揮發性,加熱促進氯化氫揮發,從而促進氯化鐵水解,蒸干時得到固體Fe(OH)3,灼燒Fe(OH)3得到Fe2O3,據此分析解答;
(2)泡沫滅火器滅火的原理為硫酸鋁和碳酸氫鈉發生互促水解生成二氧化碳氣體;
(3)根據c(待測)=$\frac{c(標準)V(標準)}{V(待測)}$分析不當操作對V(標準)×的影響,以此判斷濃度的誤差;
(4)硫酸鈉溶液是顯中性的,c(OH-)=10-7mol/L.
解答 解:FeCl3是強酸弱堿鹽,加熱過程中發生水解生成Fe(OH)3和HCl,反應方程式為FeCl3+3H2O?Fe(OH)3+3HCl,溶液顯酸性,溶液PH<7,HCl具有揮發性,加熱促進氯化氫揮發,從而促進氯化鐵水解,蒸干時得到固體Fe(OH)3,灼燒Fe(OH)3得到Fe2O3,反應方程式為2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最終得到的固體是Fe2O3,
故答案為:<;Fe2O3;
(2)泡沫滅火器滅火的原理為硫酸鋁和碳酸氫鈉發生互促水解生成二氧化碳氣體,反應的離子方程式為Al3++3HCO3-═3CO2↑+Al(OH)3↓,
故答案為:Al3++3HCO3-═3CO2↑+Al(OH)3↓;
(3)A、滴定終點讀數時,俯視滴定管的刻度,其它操作均正確,導致V(標準)偏小,結果偏低,故A錯誤;
B、盛裝未知液的錐形瓶用蒸餾水洗過,未用待測液潤洗,待測液的物質的量不變,標準液的體積不變,結果不變,故B錯誤;
C、滴定到終點讀數時發現滴定管尖嘴處懸掛一滴溶液,造成消耗的V(標準)偏大,根據c(待測)=$\frac{c(標準)V(標準)}{V(待測)}$,可知C(待測)偏大,故C正確;
D、堿式滴定管未潤洗就裝標準液滴定,造成消耗的V(標準)偏大,根據c(待測)=$\frac{c(標準)V(標準)}{V(待測)}$,可知C(待測)偏大,故D正確;
E.量取未知液的滴定管水洗后誤用標準液潤洗,消耗未知液,得到溶液中溶質減少,測定結果偏低,故E錯誤;
故答案為:C D;
(4)25℃時,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,則溶液中鈉離子濃度是1×10-3 mol/L.如果稀釋10倍,則鈉離子濃度是1×10-4 mol/L.但硫酸鈉溶液是顯中性的,c(OH-)=10-7mol/L,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案為:1000:1.
點評 本題考查了水的電離、水的離子積常數和pH的有關計算、弱電解質的電離平衡以及離子濃度大小比較,題目難度中等,本題是基礎性知識的考查,主要是鞏固學生對教材基礎知識的理解掌握程度,提高學生的解題能力.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6g鐵粉與足量Cl2反應,失去的電子數為0.2NA | |
| B. | 1.8g重水(D2O)中含有的質子數和電子數均為1.0NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反應中,生成28g N2時,轉移的電子數目為3.75NA | |
| D. | 常溫下,2.7g鋁片投入足量的濃硫酸中,鋁失去的電子數為0.3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬,化合物 | B. | 單質,純凈物 | ||
| C. | 石灰乳,膠體 | D. | 過氧化鈉,堿性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
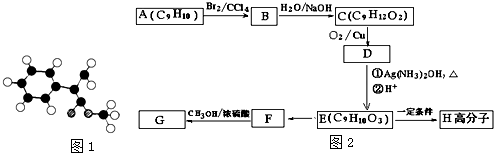
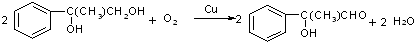 ;
;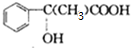 $\stackrel{一定條件下}{→}$
$\stackrel{一定條件下}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入鋁粉有大量氫氣產生的溶液中:Mg2+、K+、NO3-、SiO32- | |
| B. | 在0.1mol/L氫氧化鈉的溶液中:Na+、K+、Cr2O72-、S2- | |
| C. | 在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在0.1mol/L的硝酸溶液中:NH4+、Ca2+、Cl-、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硼(B)、鋁(Al)、鎵(Ga)均屬于硼族元素(第ⅢA族),它們的化合物或單質都有重要用途.回答下列問題:
硼(B)、鋁(Al)、鎵(Ga)均屬于硼族元素(第ⅢA族),它們的化合物或單質都有重要用途.回答下列問題: ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com