
用右圖所示實驗裝置(夾持儀器己略去)探究銅絲與過量濃硫酸的反應。下列實驗不合理的是
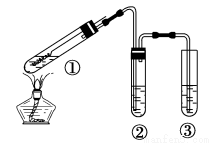
A. 上下移動①中銅絲可控制SO2的產生與停止
B. ②中選用品紅溶液驗證SO2的生成
C. ③中選用NaOH溶液吸收多余的SO2
D. 為確認有CuSO4生成,向①中加水,觀察顏色
科目:高中化學 來源:2016-2017學年遼寧省六校協作體高一下學期期初化學試卷(解析版) 題型:選擇題
化學實驗中常將溶液或試劑進行酸化,下列酸化處理的措施正確的是
A. 定性檢驗SO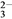 ,將BaCl2溶液用HNO3酸化
,將BaCl2溶液用HNO3酸化
B. 為提高高錳酸鉀溶液的氧化能力,用鹽酸將高錳酸鉀溶液酸化
C. 檢驗溶液中是否含有Fe2+時,用硝酸酸化
D. 檢驗溶液中是否含有SO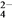 時,在無其他陽離子干擾的條件下,先用鹽酸酸化,所得溶液再加BaCl2溶液
時,在無其他陽離子干擾的條件下,先用鹽酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化學 來源:河北省2016-2017學年高一下學期開學考試化學試卷 題型:選擇題
對Al、Fe二種金屬元素,下列說法正確的是
A. 鋁能夠穩定存在于空氣中,而鐵很容易生銹,說明鐵比鋁活潑
B. 等物質的量的Al、Fe分別與足量鹽酸反應放出等質量的H2
C. 二者的氫氧化物都不可以通過氧化物化合反應直接制備
D. 二者的單質都能與強堿溶液反應生成H2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省高一下學期開學考試化學試卷(解析版) 題型:簡答題
現有含有少量NaCl、 Na2SO4、Na2CO3等雜質的NaNO3溶液,選擇適當的試劑除去雜質,得到純凈的NaNO3固體,實驗流程如下圖所示。
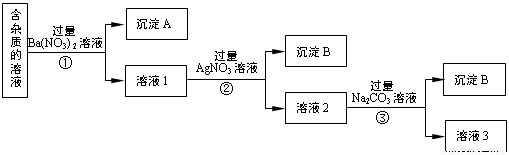
(1)沉淀A的主要成分是_____________、______________(填化學式)。
(2)①②③中均進行的分離操作是_______________。
(3)溶液3經過處理可以得到NaNO3固體,溶液3中肯定含有的雜質是__________,為了除去雜質,可向溶液3中加入適量的______________。
(4)實驗探究小組在實驗中需要用到456 mL1 mol•L-1的HNO3溶液,但是在實驗室中只發現一瓶8 mol•L-1的HNO3溶液,該小組用8mol•L-1的HNO3溶液配制所需溶液。
①實驗中所需的玻璃儀器包括_________、________mL量筒、燒杯、__________、膠頭滴管等。
②該實驗中需要量取8mol•L-1的HNO3溶液________mL。
③下列實驗操作中導致配制的溶液濃度偏高的是_____________。
A.取8mol•L-1的HNO3溶液溶液時仰視刻度線
B.量取用的量筒水洗后未進行任何操作
C. 8mol•L-1的HNO3溶液從量筒轉移至燒杯后用水洗滌量筒并全部轉移至燒杯
D.定容時仰視刻度線
E.定容后,將容量瓶振蕩搖勻后,發現液面低于刻度線,未進行任何操作
(5)某同學轉移溶液的操作如圖所示,該同學操作中的錯誤是______________________________________。容量瓶的刻度線標在比較細的瓶頸之上的原因是___________。
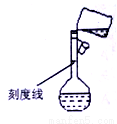
A.為了美觀 B.為了統一標準 C.為了提高準確度 D.方便刻畫
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省高一下學期開學考試化學試卷(解析版) 題型:選擇題
灼燒綠礬的反應方程式如下:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+ 14H2O。將生成的氣體通入BaCl2溶液中,下列敘述中正確的是
Fe2O3+SO2↑+SO3↑+ 14H2O。將生成的氣體通入BaCl2溶液中,下列敘述中正確的是
A. 有BaSO4生成 B. 有BaSO3生成
C. 同時有BaSO4和BaSO3生成 D. 有SO3逸出
查看答案和解析>>
科目:高中化學 來源:2016-2017學年福建省高一下學期開學考試化學試卷(解析版) 題型:選擇題
下列說法正確的是(NA表示阿伏伽德羅常數)
A. 物質的量濃度為0.5 mol•L-1的MgCl2溶液中,含有Cl-個數為NA
B. 標準狀況下,lmol H2所占體積約為22.4L,lmol H2和N2混合氣體的體積也約為22.4L
C. 0.1L0.5mol•L-1 CH3COOH溶液中含有的H+數為0.05NA
D. 2.3gNa在足量O2中燃燒,轉移的電子數為0.2NA
查看答案和解析>>
科目:高中化學 來源:2016-2017學年新疆兵團農二師華山中學高一下學期學前考試化學試卷(解析版) 題型:選擇題
把4.6 g鈉放入200 mL 0.1 mol·L-1 AlCl3溶液中,待其充分反應后,下列敘述中正確的是 ( )
A. Cl-的濃度幾乎不變
B. 溶液變渾濁
C. 溶液中Al3+全部轉化為AlO
D. 溶液中存在最多的離子是Na+
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省廣州市高一上學期期期末考試化學試卷(解析版) 題型:推斷題
Ⅰ、下圖表示的反應關系中,部分產物被略去。已知白色固體X的分解產物中只有A是白色固體,X、A、E、G的焰色反應均為黃色。
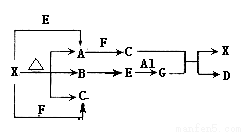
請回答下列問題:
(1)寫出X→A+B+C的化學方程式:_____________________
(2)寫出E→G的化學方程式:_________________
(3)寫出G與C反應的離子方程式:_____________________
(4)寫出在溶液中X+E→A反應的離子方程式:_________________
Ⅱ、根據下列框圖回答問題(答題時,方程式中的M、E用所對應的元素符號表示):

請回答下列問題:
(5)寫出M溶于稀H2SO4和H2O2混合液的化學方程式:________________。
(6)某同學取Y的溶液加熱煮沸除去H2O2后,冷卻,再加入淀粉KI溶液,變為藍色。寫出加入淀粉KI溶液的反應的離子方程式:_____________________。
(7)寫出Cl2將Z氧化為K2EO4的化學方程式:______________________。
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三下學期期初考試化學試卷(解析版) 題型:填空題
CO2的回收利用對減少溫室氣體排放、改善人類生存環境具有重要意義。利用CO2和CH4重整可制合成氣(主要成分CO、H2),重整過程中部分反應的熱化學方程式為: ①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol-1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol-1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol-1
(1)反應CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= ___________。
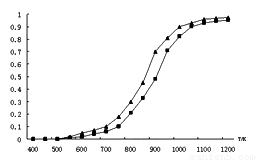
(2)固定n(CO2)= n(CH4),改變反應溫度,CO2和CH4的平衡轉化率見下圖。
①同溫度下CO2的平衡轉化率 ____________(填“大于”或“小于”)于CH4的平衡轉化率,其原因是 __________________________。
②高溫下進行該反應時常會因反應①生成“積碳”(碳單質),造成催化劑中毒,高溫下反應①能自發進行的原因是_________________。
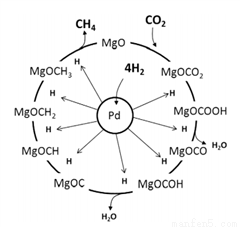
(3)一定條件下Pd-Mg/SiO2催化劑可使CO2“甲烷化”從而變廢為寶,其反應機理如圖所示,該反應的化學方程式為_____________________,反應過程中碳元素的化合價為-2價的中間體是__________。
(4)鹵水可在吸收煙道氣中CO2的同時被凈化,實現以廢治廢,其中涉及的一個反應是CaSO4 + Na2CO3 == CaCO3 + Na2SO4,則達到平衡后,溶液中c(CO32-)/c(SO42-) = __________。【用Ksp(CaSO4)和Ksp(CaCO3)表示】
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com