
| A. | 被還原的H2SO4為0.2moL | |
| B. | 反應中共轉移電子0.1moL | |
| C. | 反應消耗了金屬Cu6.4g | |
| D. | 生成的CuSO4配成500mL溶液,濃度為1mol/L |
分析 銅粉與濃硫酸混合加熱,發生反應為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,加熱條件下,濃硫酸和Cu反應生成二氧化硫但稀硫酸和Cu不反應,以此來解答.
解答 解:銅粉與濃硫酸混合加熱,發生反應為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,加熱條件下,濃硫酸和Cu反應生成二氧化硫但稀硫酸和Cu不反應,
A.由反應可知,被還原的H2SO4全部轉化為SO2,則被還原的H2SO4為0.1moL,故A不選;
B.反應生成二氧化硫為0.1mol,則轉移電子為02mol,故B不選;
C.由反應可知,n(Cu)=n(SO2)=0.1mol,則Cu的質量為0.1mol×64g/mol=6.4g,故C選;
D.由反應可知,n(Cu)=n(SO2)=n(CuSO4)=0.1mol,則生成的CuSO4配成500mL溶液,濃度為0.2mol/L,故D不選;
故選C.
點評 本題考查銅和濃硫酸的反應,側重考查基本計算,明確稀硫酸和銅不反應是解本題關鍵,根據各個物理量之間的關系式解答即可,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 硫鐵礦煅燒前需適當粉碎,目的是增大反應物轉化率 | |
| B. | 沸騰爐出來的爐氣需凈化,因為爐氣中SO2會與雜質反應 | |
| C. | 接觸室中使用熱交換器,主要目的是提高SO2的轉化率 | |
| D. | 吸收塔中用98.3%硫酸吸收SO3,目的是防止形成酸霧,SO3使吸收完全 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②③ | C. | ①② | D. | ②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
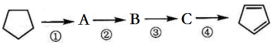
| A. | A的結構簡式是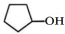 | |
| B. | ①②的反應類型分別是取代、消去 | |
| C. | 反應②③的條件分別是濃硫酸加熱、光照 | |
| D. | 酸性KMnO4溶液褪色可證明  已完全轉化成 已完全轉化成  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2:3 | B. | 1:1 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2能使品紅溶液褪色 | |
| B. | 硫在空氣中燃燒生成大量SO3 | |
| C. | 濃硫酸用作干燥劑 | |
| D. | 常溫下鋁遇濃硫酸鈍化,因此可用鋁槽車儲運濃硫酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com