

分析 根據流程可知,由于α-Al2O3不溶于稀硝酸,Ag/a-Al2O3中加入稀硝酸后銀溶解生成硝酸銀進入濾液Ⅰ,濾渣為α-Al2O3;向濾液Ⅰ中加入氯化鈉,反應生成氯化銀沉淀,則固體A為AgCl;氯化銀與氧化鐵發生反應:6AgCl+Fe2O3=3Ag2O+2FeCl3,則固體B為Ag2O,氧化銀與稀硝酸反應生成硝酸銀,濾液Ⅲ為硝酸銀溶液,對濾液Ⅲ通過蒸發濃縮、冷卻結晶得到硝酸銀固體,
(1)銀與稀硝酸反應生成硝酸銀、一氧化氮和水,據此寫出反應的離子方程式;結構決定性質,據此判斷α-Al2O3不溶于稀硝酸原因;
(2)根據流程可知,氯化銀與氧化鐵反應生成氧化銀和氯化鐵;溶液I中硝酸銀濃度較小,溶液Ⅲ中硝酸銀濃度較大,據此分析實驗目的;
(3)硝酸容易分解,銀離子容易水解,則需要在濃硝酸的氣氛中蒸發濃縮、冷卻結晶、過濾、洗滌、干燥從而得到硝酸銀固體;
(4)已知催化劑中銀的質量分數,計算銀的回收率,還必須知道催化劑的質量和硝酸銀的質量.
解答 解:根據流程可知,α-Al2O3不溶于稀硝酸,Ag/a-Al2O3中加入稀硝酸后銀溶解生成AgNO3進入濾液Ⅰ,濾渣為α-Al2O3;向濾液Ⅰ中加入NaCl,反應生成AgCl沉淀,則固體A為AgCl;AgCl與Fe2O3發生反應:6AgCl+Fe2O3=3Ag2O+2FeCl3,則固體B為Ag2O,Ag2O與稀硝酸反應生成AgNO3,濾液Ⅲ為AgNO3溶液,對濾液Ⅲ通過蒸發濃縮、冷卻結晶得到AgNO3固體,
(1)Ag與稀硝酸反應生成硝酸銀、一氧化氮和水,反應的離子方程式為:3Ag+NO3-+4H+=NO↑+3Ag++2H2O;
不同結構具有不同的性質,α-Al2O3與普通Al2O3相比,不溶于酸的原因可能是α-Al2O3與普通Al2O3結構不同,
故答案為:3Ag+NO3-+4H+=NO↑+3Ag++2H2O;α-Al2O3與普通Al2O3結構不同;
(2)根據流程可知,氯化銀與氧化鐵反應生成氯化鐵和氧化銀,反應的化學方程式為:6AgCl+Fe2O3=3Ag2O+2FeCl3;溶液I中硝酸銀濃度較小,溶液Ⅲ中硝酸銀濃度較大,所以從溶液I轉化到溶液Ⅲ的目的是除雜質且富集AgNO3,
故答案為:6AgCl+Fe2O3=3Ag2O+2FeCl3;富集AgNO3;
(3)從溶液Ⅲ到AgNO3晶體的操作為:在硝酸的氣氛中蒸發濃縮、冷卻結晶,然后過濾、洗滌、干燥獲得硝酸銀固體;由于硝酸銀容易見光分解,需要避光保存,即:將硝酸銀保存在棕色廣口瓶中,
故答案為:HNO3;b;e;
(4)要計算Ag的回收率必須知道催化劑的質量,再由所給Ag的質量分數求出Ag的質量,另外要知道最后所得AgNO3的質量,
故答案為:催化劑的質量;AgNO3的質量.
點評 本題考查了物質制備方案的設計、化學實驗基本操作方法的綜合應用,題目難度中等,正確理解題干流程、明確反應原理為解答關鍵,注意掌握物質分離、提純方法及化學實驗基本操作方法的綜合應用,試題有利于培養學生的分析、理解能力及化學實驗能力.


 一卷搞定系列答案
一卷搞定系列答案 名校作業本系列答案
名校作業本系列答案 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:選擇題
| A. | FeBr3作催化劑,苯和溴水發生反應可生成無色、比水重的液體溴苯 | |
| B. | 將銅絲彎成螺旋狀,在酒精燈上加熱變黑后,立即伸入盛有無水乙醇的試管中,實現乙醇被氧化為乙醛的實驗 | |
| C. | 使用AgNO3溶液驗證三氯甲烷中是否含有氯元素,現象是產生白色沉淀 | |
| D. | 可以用水鑒別硝基苯、乙醇、四氯化碳三種有機物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
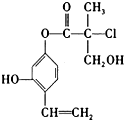
| A. | 1mol A最多可以與2mol Br2發生反應 | |
| B. | A在一定條件下可以發生消去反應和取代反應 | |
| C. | 一個A分子中最多有8個碳原子在同一平面上 | |
| D. | 1mol A與足量的NaOH溶液反應,最多可以消耗3mol NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
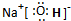 物質I是極性分子(填極性或非極性)
物質I是極性分子(填極性或非極性)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com