
| A. | Ag是還原劑 | B. | O2被還原 | C. | H2S發生氧化反應 | D. | Ag2S是氧化產物 |
分析 4Ag+2H2S+O2═2Ag2S+2H2O,反應中Ag在反應中化合價升高,為還原劑,氧氣在反應中化合價降低,為氧化劑,生成的Ag2S僅是氧化產物,H2O為還原產物,據此分析.
解答 解:A.Ag在反應中化合價升高,為還原劑,故A正確;
B.反應中O元素化合價降低,得電子被還原,故B正確;
C.反應中H、S元素的化合價沒有變化,所以H2S既不是氧化劑又不是還原劑,沒有發生還原反應,故C錯誤;
D.Ag在反應中化合價升高,為還原劑,則Ag2S是氧化產物,故D正確.
故選C.
點評 本題考查氧化還原反應,題目難度不大,注意從化合價變化的角度判斷,注意該反應中S元素的化合價沒有變化,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 蒸餾時,溫度計水銀球應放置在蒸餾燒瓶的支管口,以測量蒸氣溫度 | |
| B. | 實驗室制備乙烯時,溫度計水銀球應放置在溶液中,以測量溶液溫度 | |
| C. | 實驗室制備乙烯時,可以使用體溫計代替溫度計控制溶液溫度 | |
| D. | 控制反應溫度在50-60℃之間比較好的方法是用水浴加熱,用溫度計控制水浴溫度在50-60℃之間 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素原子的核外電子排布決定該元素在周期表中的位置 | |
| B. | 化學反應的焓變與其一定量的反應物、生成物內部所貯存的能量差異有關 | |
| C. | 同一周期元素原子最外層電子數越多,其元素的第一電離能越大 | |
| D. | 元素的非金屬性越強其對應的而最高價含氧酸的酸性也越強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 海水蒸發制海鹽的過程是化學變化 | |
| B. | 海洋中有豐富的潮汐能、波浪能等新型能源 | |
| C. | 海水中提取溴單質的過程涉及氧化還原反應 | |
| D. | 海水淡化的方法主要有蒸餾法、離子交換法和電滲析發等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂、鋁的熔點很高,可用于制耐火坩堝 | |
| B. | 小蘇打受熱分解生成氣體,可用作發酵粉 | |
| C. | 鐵的活潑性較強,鐵粉可用作食品袋內的脫氧劑 | |
| D. | Na、Cu等金屬化合物焰色反應呈現各種艷麗色彩,可制成節日煙花 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 結論 |
| A | 溶液中加入鹽酸,再滴加BaCl2溶液 | 先無現象,后產生白色沉淀 | 原溶液中有SO42- |
| B | 向兩份蛋白質溶液中分別滴加飽和Na2SO4溶液和CuSO4溶液 | 均有固體析出 | 蛋白質均發生變性 |
| C | 將Mg、Al與NaOH溶液組成原電池 | Mg電極溶解 | Mg比Al金屬活動性強 |
| D | 向稀HNO3溶液中加入過量鐵粉充分反應后,滴入KSCN溶液 | 溶液變為血紅色 | 和HNO3具有氧化性,能將Fe氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
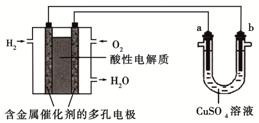
| A. | 燃料電池工作時,正極反應為:O2+2H2O+4e-═4OH- | |
| B. | a極是鐵,b極是銅時,b極逐漸溶解,a極上有銅析出 | |
| C. | a極是粗銅,b極是純銅時,a極逐漸溶解,b極上有銅析出 | |
| D. | a、b兩極均是石墨時,a極上產生的O2與電池中消耗的H2的體積比為2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷、乙烯和苯在工業上都可通過石油分餾得到 | |
| B. | 鋼鐵在潮濕的空氣中放置,易發生化學腐蝕而生銹 | |
| C. | 綠色化學的核心是從源頭上消除工業生產對環境的污染 | |
| D. | 汽油、柴油和植物油都是碳氫化合物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com