
| 反應時間/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 壓強/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
分析 (I)由表中數據可知,20min反應到達平衡,恒溫恒容下,壓強之比等于物質的量之比,則平衡時混合氣體總物質的量為(1+2)mol×$\frac{8.4mol}{12.6mol}$=2mol,則:
CO(g)+2H2(g)?CH3OH(g) 物質的量減小△n=2
起始量(mol):1 2 0
變化量(mol):0.5 1 0.5 3-2=1
平衡量(mol):0.5 1 0.5
(1)根據v=$\frac{△c}{△t}$計算v(CO);
(2)根據K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$計算平衡常數;正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小;
(3)可逆反應到達平衡時,同種物質的正逆速率相等且保持不變,各組分的濃度、含量保持不變,由此衍生的其它一些量不變,判斷平衡的物理量應隨反應進行發(fā)生變化,該物理量由變化到不再變化說明到達平衡;
(Ⅱ)(1)正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小;
(2)可逆反應得到平衡時,反應各組分的物質的量不變;
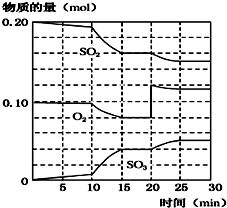
(3)由圖可知,20min時平衡向正反應移動,瞬間只有氧氣的濃度增大;
反應向正反應進行,10min到15min反應混合物單位時間內的變化量增大,說明反應速率增大,10min改變瞬間,各物質的物質的量不變;
(4)提高二氧化硫轉化率,改變條件使平衡正向進行,但不能只增大二氧化硫的濃度.
解答 解:(I)由表中數據可知,20min反應到達平衡,恒溫恒容下,壓強之比等于物質的量之比,則平衡時混合氣體總物質的量為(1+2)mol×$\frac{8.4mol}{12.6mol}$=2mol,則:
CO(g)+2H2(g)?CH3OH(g) 物質的量減小△n=2
起始量(mol):1 2 0
變化量(mol):0.5 1 0.5 3-2=1
平衡量(mol):0.5 1 0.5
(1)從反應開始到20min時,以CO表示的平均反應速率v(CO)=$\frac{\frac{0.5mol}{2L}}{20min}$=0.0125mol/(L•min),
故答案為:0.0125mol/(L•min);
(2)該溫度下平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{0.5mol}{2L}}{\frac{0.5mol}{2L}×(\frac{1mol}{2L})^{2}}$=4(mol/L)-2,
正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小,
故答案為:4(mol/L)-2;減小;
(3)A.應是v (H2)正=2v (CH3OH)逆時,可逆反應到達平衡,故A錯誤;
B.混合氣體總質量不變,隨反應進行混合氣體總物質的量進行,容器內氣體的平均摩爾質量減小,當平均摩爾質量保持不變時,說明反應到達平衡,故B正確;
C.隨反應進行混合氣體物質的量減小,恒溫恒容下容器內壓強減小,當容器中氣體的壓強保持不變,說明可逆反應到達平衡,故C正確;
D.單位時間內生成 n molCO 的同時生成 2n molH2,均表示逆反應速率,反應始終按該比例關系進行,故D錯誤,
故選:BC;
(Ⅱ)(1)2SO2(g)+O2(g)?2SO3(g)△H=-190kJ•mol-1,正反應是放熱反應,升溫平衡逆向進行,平衡常數減小,所以該反應500℃時的平衡常數小于該反應400℃時的平衡常數,故答案為:<;
(2)反應混合物各物質的物質的量不變化,說明反應處于平衡狀態(tài),由圖可知在15-20min和25~30 min出現平臺,各組分的物質的量不變,反應處于平衡狀態(tài),故答案為:15-20min和25~30 min;
(3)由圖可知,反應進行至20min時,平衡向正反應移動,瞬間只有氧氣的濃度增大,應是增大O2濃度(通入O2);
由圖可知,反應向正反應進行,10min到15min反應混合物單位時間內的變化量增大,說明反應速率增大,10min改變瞬間,各物質的物質的量不變,
A.加了催化劑,增大反應速率,故A正確;
B.縮小容器體積,增大壓強,增大反應速率,故B正確;
C.降低溫度反應速率降低,故C錯誤;
D.10min改變瞬間,各物質的物質的量不變,不是增加SO3的物質的量,故D錯誤;
故答案為:增大O2濃度(通入O2);AB;
(4)a.向裝置中再充入N2,恒溫恒容容器,總壓增大,分壓不變,平衡不動,故a不符合;
b.兩種反應物增加一種會提高另一種的轉化率,向裝置中再充入O2,二氧化硫轉化率增大,故b符合;
c.改變反應的催化劑,改變反應速率但不改變化學平衡,故二氧化硫轉化率不變,故c不符合;
d.反應是放熱反應,升高溫度平衡逆向進行,二氧化硫轉化率減小,故d不符合;
故答案為:b.
點評 本題考查化學平衡計算與影響因素、化學平衡狀態(tài)判斷、反應速率計算與影響因素、平衡常數、化學平衡圖象等,注意判斷平衡的物理量應隨反應進行發(fā)生變化,該物理量由變化到不再變化說明到達平衡.


科目:高中化學 來源: 題型:填空題
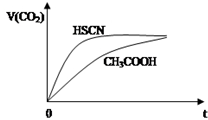 已知25℃時有關弱酸的電離平衡常數:
已知25℃時有關弱酸的電離平衡常數:| 弱酸化學式 | HSCN | CH3COOH | HCN | H2CO3 |
| 電離平衡常數 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉質軟,可用小刀切割 | |
| B. | 鈉要保存在煤油或者石蠟油中 | |
| C. | 鈉著火可用干沙撲滅 | |
| D. | 鈉與氧氣反應,產物是由氧氣的量決定的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為使水果保鮮,可在水果箱內放入高錳酸鉀溶液浸泡過的硅藻土 | |
| B. | PM2.5表面積大,能吸附大量的有毒、有害物質 | |
| C. | 高純硅在太陽能電池及信息高速傳輸中有重要應用 | |
| D. | 從海水中提取物質不一定要通過化學反應實現 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同濃度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的順序是:①>③>② | |
| B. | 常溫時,將等體積的鹽酸和氨水混合后,pH=7,則c(NH4+)>c(Cl-) | |
| C. | 0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 0.1mol/L的NH4Cl溶液與0.05mol/L NaOH溶液等體積混合顯堿性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Pb2++2CH3COO-+2H++S2-═PbS↓+2CH3COOH | |
| B. | Pb2++H2S═PbS↓+2H+ | |
| C. | Pb2++2CH3COO-+H2S═PbS↓+2CH3COOH | |
| D. | (CH3COO)2Pb+H2S═PbS↓+2CH3COOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KClO3和SO3溶于水后能導電,故KClO3和SO3為電解質 | |
| B. | 25℃時、用醋酸溶液滴定等濃度NaOH溶液至pH=7,V醋酸>VNaOH | |
| C. | 在蒸餾水中滴加濃H2SO4,KW不變 | |
| D. | NaCl 溶液和CH3COONH4溶液均顯中性,兩溶液中水的電離程度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com