
【題目】乙酸正丁酯(CH3CH2CH2CH2OOCCH3)是一種優良的有機溶劑。實驗室制備少量乙酸正丁酯的反應為CH3COOH+CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OOCCH3+H2O。
CH3CH2CH2CH2OOCCH3+H2O。
實驗步驟如下:
步驟1:向儀器A中加入11.5 mL正丁醇(微溶于水)、1 mL濃H2SO4、7.2 mL冰醋酸及沸石少許。
步驟2:按如圖連接裝置。
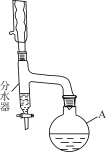
步驟3:向分水器中預先加少量水(略低于支管口)。通入冷卻水,加熱回流。
步驟4:將分水器分出的酯層和反應液合并轉入分液漏斗中,依次用5% Na2CO3溶液、水洗滌,分離出有機相。
步驟5:將有機相用無水硫酸鎂干燥、過濾、蒸餾,收集乙酸正丁酯。
(1)儀器A的名稱是________;向其中加入碎瓷片的目的是________。
(2)裝置中分水器的作用是________,判斷反應已經完成的標志是________。
(3)反應時生成的主要有機副產物有丁醚和________(用結構簡式表示)。
(4)步驟4中,分離出有機相的具體操作是___________________。
【答案】圓底燒瓶 防止暴沸 分離出酯化反應生成的水同時酯層中正丁醇回流至燒瓶中繼續反應 水層高度不再變化 CH3CH2CH=CH2 先放出下層的水層,再將有機層從上口倒入一個干燥的燒杯中
【解析】
(1)根據儀器結構判斷儀器名稱;液體混合物加熱時加入碎瓷片可防止暴沸;
(2)結合產生的物質及正丁醇的沸點低,易揮發進入分水器,且不易溶于水分析;
(3)結合醇的化學性質與反應溫度的關系分析判斷;
(4)根據酯的密度比水小,難溶于水分析。
(1)根據圖示可知儀器A是圓底燒瓶;向其中加入碎瓷片的目的是防止產生暴沸現象;
(2)乙酸與正丁醇在濃硫酸存在時,在加熱條件下發生酯化反應產生乙酸正丁酯和水,由于正丁醇沸點比較低,易揮發,且在水中微溶,反應生成的酯及水和揮發的未反應的醇進入分水器,分水器在能分離出酯化反應生成的水的同時,還可以使酯層中正丁醇回流至燒瓶中繼續反應,可提高原料利用率;
若反應完全,則不再有正丁醇揮發進行分水器中,分水器中液面不升高,此時說明反應達到終點;
(3)在加熱時反應時,可能有部分正丁醇分子之間脫水形成副產物丁醚;若加熱溫度過高,還會發生正丁醇分子內脫水生成1-丁烯:CH3CH2CH=CH2;故該反應的有機副產物有丁醚和CH3CH2CH=CH2;
(4)反應產生的乙酸正丁酯是難溶于水,密度比水小的液體,分離互不相溶的兩層液體物質使用分液方法分離,即將混合物通過分液漏斗下口先放出下層的水層,然后關閉活塞,再將有機層從上口倒入一個干燥的燒杯中。


科目:高中化學 來源: 題型:
【題目】下列關系圖中,A是一種正鹽,B是氣態氫化物,C是單質,F是強酸。當X無論是強酸還是強堿時都有如下轉化關系(其他反應產物及反應所需條件均已略去),當X是強堿時,過量的B跟Cl2反應除生成C外,另一產物是鹽酸鹽。
![]()
下列說法中不正確的是( )
A. 當X是強酸時,A、B、C、D、E、F中均含同一種元素,F可能是H2SO4
B. 當X是強堿時,A、B、C、D、E、F中均含同一種元素,F是HNO3
C. B和Cl2的反應是氧化還原反應
D. 當X是強酸時,C在常溫下是氣態單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前含有元素硒![]() 的保健品已開始涌入市場,已知它與氧同主族,而與鈣同周期,下列關于硒的有關描述中不正確的是
的保健品已開始涌入市場,已知它與氧同主族,而與鈣同周期,下列關于硒的有關描述中不正確的是
A.原子序數為24B.最高價氧化物為SeO3,為酸性氧化物
C.原子半徑比鈣小D.氣態氫化物分子式為H2Se,受熱較容易分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莧菜甲素、3-丁烯基苯酞、藁本內酯是傳統中藥當歸、川芎中的活性成分。下列有關說法正確的是( )
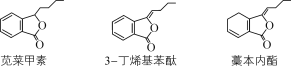
A.莧菜甲素、藁本內酯互為同分異構體
B.1 mol 3-丁烯基苯酞與溴水反應最多消耗4 mol Br2
C.3-丁烯基苯酞通過還原反應可制得莧菜甲素
D.藁本內酯與足量H2加成的產物分子中含有2個手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣是一種清潔能源,它的制取與應用一直是人類研究的熱點。
(1)用甲醇和水蒸氣在催化劑、加熱條件下制氫的相關熱化學方程式如下:
CH3OH(g)=CO(g)+2H2(g);ΔH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-41.2 kJ/mol
①反應CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)能自發進行的原因是________。
CO2(g)+3H2(g)能自發進行的原因是________。
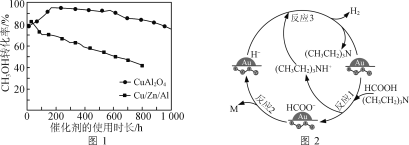
②將一定比例的CH3OH(g)和H2O(g)的混合氣體,以相同速率通過裝有不同催化劑的反應器。CH3OH轉化率隨催化劑的使用時長變化如圖1所示,催化劑CuAl2O4與催化劑Cu/Zn/Al相比,優點有____________________。
③向Cu(NO3)2、Al(NO3)3混合溶液中滴加NaOH溶液可獲得沉淀物[Cu(OH)2、Al(OH)3],以便于制取CuAl2O4。為確保Cu2+、Al3+完全沉淀(濃度≤10-5 mol/L),應控制混合液pH的最小整數值為________{Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33}。
(2)用Au/ZrO2作催化劑,在(CH3CH2)3N作用下HCOOH分解制氫的原理如圖2所示。反應2中生成物M的化學式為__________________,圖示反應中只有氫元素化合價發生變化的是反應________(填“1”“2”或“3”)。
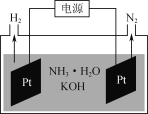
(3)如圖是電解氨水和KOH混合溶液制氫的裝置示意圖。生成N2的電極反應式為______________。
(4)富氧條件下,H2還原NOx包括兩個階段:第一階段為H2、NOx在催化劑作用下轉變為H2O、N2、NH3;第二階段NH3在載體酸的作用下生成NH4+,NH4+將NOx還原為N2。寫出NO與O2的物質的量之比為1∶1時,NH4+與NO、O2反應生成N2的離子反應方程式:__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某礦渣的成分為Cu2O、Al2O3、Fe2O3、FeO、SiO2,工業上用該礦渣獲取銅和膽礬的操作流程如圖:
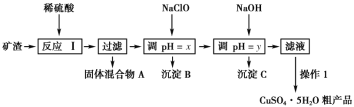
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分陽離子以氫氧化物形式沉淀時溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
開始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)為了加快反應Ⅰ的速率,可以采取的措施是__(任寫1條)。
(2)固體混合物A中的成分是__。
(3)反應Ⅰ完成后,鐵元素的存在形式為__(填離子符號);檢驗該離子常用的方法之一是:取少量含該離子的溶液于試管中,滴加幾滴鐵氰化鉀溶液,會產生沉淀,寫出該反應的離子方程式__。
(4)操作1主要包括:__、__、__。洗滌CuSO4·5H2O粗產品不能用大量水洗,而用冰水洗滌。原因是__。
(5)用NaClO調pH可以生成沉淀B,利用題中所給信息分析沉淀B為__,該反應中氧化劑與還原劑的物質的量之比為__。
(6)用NaOH調pH可以生成沉淀C,利用題中所給信息分析y的范圍為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組利用下圖所列裝置進行“鐵與水蒸氣反應”的實驗,并利用產物進一步制取FeCl3·6H2O晶體。(圖中夾持及尾氣處理裝置均已略去)
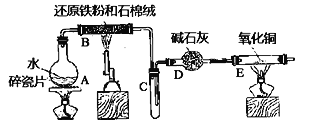
回答下列問題:
(1)裝置B中發生反應的化學方程式是__________
(2)E中出現______________的現象。
(3)該小組把B中反應后的產物加入足量的鹽酸,用該溶液制取FeCl3·6H2O晶體。
①欲檢驗溶液中含有Fe3+,選用的試劑為____________,現象是__________
②該實驗小組同學用上述試劑沒有檢測到Fe3+,用離子方程式解釋濾液中不存在Fe3+可能的的原因:___________。
③將此濾液中FeCl2完全氧化為FeCl3最好選擇_______做氧化劑。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】太陽能電池在日常生活中已廣泛應用,一種替代硅光電池的全天候太陽能電池已投入商用,其工作原理如圖。下列說法不正確的是()
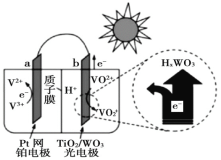
A.硅太陽能電池工作原理與該電池不相同
B.夜間時,該電池相當于蓄電池放電,a 極發生氧化反應
C.光照時,b 極的電極反應式為VO2+﹣e﹣+H2O=VO![]() +2H+
+2H+
D.光照時,每轉移 1mol 電子,有 2 mol H+ 由 b 極區經質子交換膜向 a 極區遷移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】厭氧氨化法(Anammox)是一種新型的氨氮去除技術,下列說法中不正確的是

A. 1mol NH4+ 所含的質子總數為10NA
B. 聯氨(N2H4)中含有極性鍵和非極性鍵
C. 過程II屬于氧化反應,過程IV屬于還原反應
D. 過程I中,參與反應的NH4+與NH2OH的物質的量之比為1:1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com