

分析 (1)提高反應中Cl2的平衡轉化率,即改變條件使平衡向正反應移動,根據平衡移動原理結合選項分析解答,注意不能只增大氯氣的用量;
(2)300℃時,在體積為1L的密閉容器中充入16.20g SO2Cl2,發生反應:SO2Cl2(l)?SO2(g)+Cl2(g)△H=+97.3kJ/mol.然后根據n=$\frac{m}{M}$計算SO2的物質的量,由方程式Cl2的物質的量等于SO2的物質的量,計算二者的濃度,則300℃時分解SO2Cl2反應的平衡常數帶入K=$\frac{c(S{O}_{2})c(C{l}_{2})}{c(S{O}_{2}C{l}_{2})}$計算可得,而300℃時合成SO2Cl2反應的平衡常數與之互為倒數;
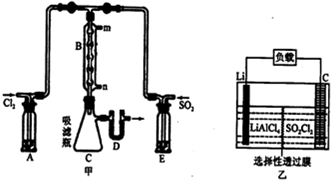
(3)①a.根據飽和食鹽水和飽和NaHSO3溶液起不到干燥的作用判斷;
b.B處反應管內五球中玻璃棉上的活性炭對氯氣和二氧化硫的反應起催化作用;
c.根據B處反應管冷卻水應低處進高處出判斷;
d.根據反應放熱,則裝置C處吸濾瓶應放在冰水中冷卻有利于利平衡正向移動判斷;
e.根據D處U形管中盛放的固體干燥劑判斷;
②SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,正反應是放熱反應,所以水冷卻利于SO2Cl2的合成;
③氯磺酸(C1SO3H)加熱分解,也能制得硫酰氯(SO2Cl2)與另外一種物質,由元素守恒可知,另外物質含有H元素,C1SO3H中S、Cl原子數目之比為1:1,而SO2Cl2中S、Cl原子數目之比為1:2,故另外物質中含有S元素,結合原子守恒可知另外物質為H2SO4;二者為互溶液體,沸點相差較大,采取蒸餾法進行分離;
(4)正極是SO2Cl2中+6價的硫得電子發生還原反應,據此書寫.
解答 解:(1)提高反應中Cl2的平衡轉化率,改變條件使平衡向正反應移動,不能只增大氯氣的用量,
a.縮小容器體積,壓強增大,平衡向正反應移動,Cl2的轉化率增大,故a正確;
b.使用催化劑,縮短到達平衡的時間,不影響平衡移動,Cl2的轉化率不變,故b錯誤;
c.增加SO2濃度,平衡向正反應移動,Cl2的轉化率增大,故c正確;
d.該反應正反應是放熱反應,提高溫度,平衡向逆反應移動,Cl2的轉化率降低,故d錯誤;
故答案為:ac;
(2)300℃時,在體積為1L的密閉容器中充入16.20gSO2Cl2,發生反應:SO2Cl2(g)?SO2(g)+Cl2(g),SO2的物質的量為$\frac{7.616g}{64g/mol}$=0.119mol,由方程式可知,n(Cl2)=n(SO2)=0.119mol,二者濃度都為$\frac{0.119mol}{1L}$=0.119mol/L,故參加反應的SO2Cl2的物質的量為0.119mol,SO2Cl2的物質的量為$\frac{16.2g}{135g/mol}$=0.12mol,平衡時SO2Cl2的物質的量為0.12mol-0.119mol=0.001mol,故SO2Cl2的平衡濃度為$\frac{0.001mol}{1L}$=0.001mol/L,300℃時分解SO2Cl2反應的平衡常數K=$\frac{c(S{O}_{2})c(C{l}_{2})}{c(S{O}_{2}C{l}_{2})}$=$\frac{1.119×0.119}{0.001}$,所以300℃時合成SO2Cl2反應的平衡常數K=$\frac{0.001}{1.119×0.119}$=0.0706;
故答案為:0.0706;
(3)①a.A、E處洗氣瓶,干燥吸水,二氧化硫和氯氣都可以用濃硫酸干燥,而飽和食鹽水和飽和NaHSO3溶液起不到干燥的作用,故a錯誤;
b.B處反應管內五球中玻璃棉上的活性炭對氯氣和二氧化硫的反應起催化作用,故b正確;
c.B處反應管冷卻水應低處進高處出,所以從n接口通入,故c錯誤;
d.裝置C處吸濾瓶應放在冰水中冷卻,利平衡正向移動,提高產率,故d正確;
e.D處U形管中盛放的固體干燥劑,可能是固體堿石灰,故e正確;
故選:bde;
②SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,正反應是放熱反應,所以水冷卻利于SO2Cl2的合成,故答案為:冷凝、降溫均有利于SO2Cl2生成;
③氯磺酸(C1SO3H)加熱分解,也能制得硫酰氯(SO2Cl2)與另外一種物質,由元素守恒可知,另外物質含有H元素,C1SO3H中S、Cl原子數目之比為1:1,而SO2Cl2中S、Cl原子數目之比為1:2,故另外物質中含有S元素,結合原子守恒可知另外物質為H2SO4,反應方程式為:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4,二者為互溶液體,沸點相差較大,采取蒸餾法進行分離;
故答案為:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;蒸餾;
(4)正極是SO2Cl2中+6價的硫得電子發生還原反應,所以電極反應式為:SO2Cl2+2e-=2Cl-+SO2↑,故答案為:SO2Cl2+2e-=2Cl-+SO2↑.
點評 本題考查實驗制備方案,涉及對反應原理及操作的分析評價、物質的分離提純、化學平衡常數的計算以及平衡移動原理等,注意對物質性質信息的應用,難度中等.


 全程金卷系列答案
全程金卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 有機物A屬于醛類 | B. | 有機物A與B屬于同系物 | ||
| C. | 有機物C能與H2發生加成反應 | D. | 有機物D的一氯代物有2種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,無水HF的作用是反應物和溶劑
,無水HF的作用是反應物和溶劑查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 都能與氫氧化鈉發生中和反應 | B. | 都能使紫色石蕊試液變紅 | ||
| C. | 都能發生酯化反應 | D. | 都能和金屬鈉反應生成H2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com