
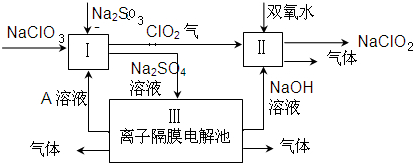
分析 (1)根據反應Ⅰ、Ⅲ中發生的反應進行解答,還原劑是指有元素化合價的物質;
(2)根據(1)的解答可知A為硫酸;
(3)根據在反應物中,化合價降低的物質是氧化劑,化合價升高的物質是還原劑來分析解答;
(4)NaClO2變質可分解為NaClO3和NaCl,方程式為3NaClO2=2NaClO3+NaCl,NaClO2試樣與足量FeSO4溶液反應3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,運用氧化還原反應理論電子轉移判斷解答.
解答 解:(1)由流程圖可知反應Ⅰ,反應物為NaClO3、Na2SO3、加入A溶液,產生C1O2、Na2SO4溶液,反應離子方程式為2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,所以Na2SO3具有還原性是還原劑,將ClO3-還原為C1O2;Ⅲ是離子隔膜電解池,從反應Ⅰ知該電解有酸生成、從Ⅲ知有堿生成,有兩種氣體生成,所以Ⅲ為電解硫酸鈉本質是電解水,陰極2H++2e-=H2↑,陽極4OH--4e-=O2↑+2H2O,所以A為硫酸,為陽極放出氧氣,水既是氧化劑,又是還原劑,
故答案為:Na2SO3;H2O;
(2)Ⅲ為電解硫酸鈉本質是電解水,陰極2H++2e-=H2↑,陽極4OH--4e-=O2↑+2H2O,所以A為硫酸,
故答案為:H2SO4;
(3)5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反應中,4NaClO2→4ClO2,+3價的氯元素化合價升高到+4價,所以NaClO2是還原劑;1NaClO2→1NaCl,+3價的氯元素的化合價降低到-1價,所以部分NaClO2作氧化劑;所以該反應中氧化劑和還原劑的物質的量之比為1:4,
故答案為:1:4;
(4)NaClO2變質可分解為NaClO3和NaCl,Cl元素從+3價變為+5價和-1價,反應為3NaClO2=2NaClO3+NaCl,NaClO2試樣與足量FeSO4溶液反應3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,最終得到Cl元素由+3價變為-1價,所以NaClO2變質前后分別與Fe2+反應時,最終消耗Fe2+的物質的量相同,均得到等量NaCl,Cl元素均由+3價變為-1價,根據電子守恒,兩個過程中得到的電子的物質的量相同,
故選C.
點評 本題考查生產NaClO2的制備實驗的工業設計,把握物質的性質熟練運用氧化還原反應為解答該題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
 ;一種由B、C組成的化合物與AC2互為等電子體,其化學式為N2O.
;一種由B、C組成的化合物與AC2互為等電子體,其化學式為N2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg2+結構示意圖: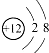 | B. | CCl4分子的比例模型: | ||
| C. | NH4Cl的電子式: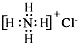 | D. | 2-甲基丁醇的結構簡式: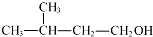 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
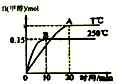
| A. | 混合氣體的密度不變能說明該反應到達平衡狀態 | |
| B. | a>0 | |
| C. | 其他條件不變,若減小容積體積,CO質量分數增大 | |
| D. | 平衡常數K:T℃時大于250℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
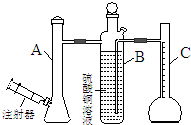
| A. | 反應前后抽氣使B中導管內外液面持平 | |
| B. | 用飽和食鹽水代替A裝置中的蒸餾水 | |
| C. | 把A裝置浸入盛有冰水混合物的水槽中 | |
| D. | 在B裝置中的硫酸銅溶液表面覆蓋一層苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
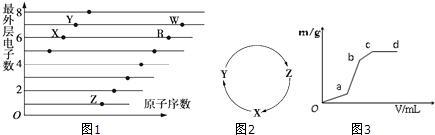
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com