
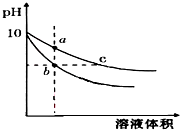
 常溫下,相同pH的氫氧化鈉和醋酸鈉溶液加水稀釋,平衡時pH 隨溶液體積變化的曲線如圖所示,則下列敘述不正確的是( )
常溫下,相同pH的氫氧化鈉和醋酸鈉溶液加水稀釋,平衡時pH 隨溶液體積變化的曲線如圖所示,則下列敘述不正確的是( )| A. | b、c兩點溶液的導電能力不相同 | |
| B. | a、b、c三點溶液中水的電離程度a>c>b | |
| C. | 用相同濃度的鹽酸分別與等體積的b、c處溶液反應,消耗鹽酸體積Vb=Vc | |
| D. | c點溶液中C(H+)+C(CH3COOH)=C(OH-) |
分析 NaOH是強電解質,CH3COONa是強堿弱酸鹽,加水稀釋促進醋酸根離子水解,稀釋相同的倍數時,溶液中c(OH-)CH3COONa>NaOH,所以pH變化大的是NaOH,則b為NaOH,變化小的是CH3COONa,即c為CH3COONa,
A.溶液的導電能力與離子濃度成正比;
B.酸或堿抑制水電離,含有弱離子的鹽促進水電離;
C.D.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同體積相同pH的醋酸鈉和氫氧化鈉溶液消耗相同濃度的鹽酸體積與氫氧化鈉和醋酸鈉的物質的量成正比;
D.任何電解質溶液中都存在質子守恒,根據質子守恒判斷.
解答 解:NaOH是強電解質,CH3COONa是強堿弱酸鹽,加水稀釋促進醋酸根離子水解,稀釋相同的倍數時,溶液中c(OH-)CH3COONa>NaOH,所以pH變化大的是NaOH,則b為NaOH,變化小的是CH3COONa,即c為CH3COONa,
A.溶液的導電能力與離子濃度成正比,pH相等的醋酸鈉和氫氧化鈉,c(CH3COONa)>c(NaOH),所以c點導電能力大于b,即b、c兩點溶液的導電能力不相同,故A正確;
B.氫氧化鈉對水的電離起抑制作用,而醋酸根離子濃度越大對水的電離程度越促進,所以a、b、c三點溶液中水的電離程度大小為:a>c>b,故B正確;
C.pH相等的NaOH和CH3COONa溶液,c(CH3COONa)>c(NaOH),相同體積相同pH的醋酸鈉和氫氧化鈉溶液消耗相同濃度的鹽酸體積與氫氧化鈉和醋酸鈉的物質的量成正比,相同體積相同pH的醋酸鈉和氫氧化鈉溶液n(CH3COONa)>n(NaOH),所以醋酸鈉消耗鹽酸多,消耗鹽酸體積Vb<Vc,故C錯誤;
D.任何電解質溶液中都存在質子守恒,根據質子守恒得c(H+)+c(CH3COOH)=c(OH-),故D正確;
故選C.
點評 本題考查了鹽類水解,涉及離子濃度大小比較、溶液導電能力大小比較、水的電離程度等知識點,題目難度中等,根據溶液中的溶質及其性質是解本題關鍵,再結合質子守恒、溶液導電能力與離子濃度的關系等知識點來分析解答.


 培優三好生系列答案
培優三好生系列答案 優化作業上海科技文獻出版社系列答案
優化作業上海科技文獻出版社系列答案科目:高中化學 來源: 題型:解答題
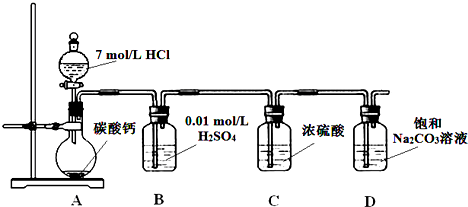
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放電時儲氫合金作正極 | |
| B. | 充電時儲氫合金作負極 | |
| C. | 充電時陽極周圍c(OH-)減少 | |
| D. | 放電時負極反應為LaNi5H6-6e-═LaNi5+6H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
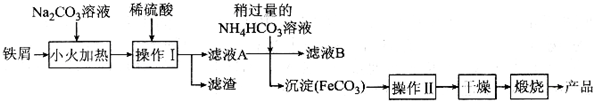
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
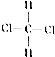 和
和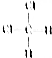 ⑧乙烷和戊烷
⑧乙烷和戊烷查看答案和解析>>
科目:高中化學 來源: 題型:解答題
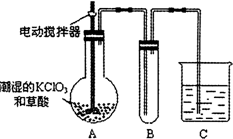 用二氧化氯(ClO2)、鐵酸鈉(Na2FeO4摩爾質量為166g/mol)等新型凈水劑替代傳統的凈水劑Cl2對淡水進行消毒是城市飲用水處理新技術.ClO2和Na2FeO4在水處理過程中分別被還原為Cl-和Fe3+.
用二氧化氯(ClO2)、鐵酸鈉(Na2FeO4摩爾質量為166g/mol)等新型凈水劑替代傳統的凈水劑Cl2對淡水進行消毒是城市飲用水處理新技術.ClO2和Na2FeO4在水處理過程中分別被還原為Cl-和Fe3+.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有5.6 g金屬被腐蝕 | B. | 有6.5 g金屬被氧化 | ||
| C. | 有0.15 mol金屬失去電子 | D. | 標準狀況下有4.48 L H2逸出 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com