
 用二氧化氯(ClO2)、鐵酸鈉(Na2FeO4摩爾質量為166g/mol)等新型凈水劑替代傳統的凈水劑Cl2對淡水進行消毒是城市飲用水處理新技術.ClO2和Na2FeO4在水處理過程中分別被還原為Cl-和Fe3+.
用二氧化氯(ClO2)、鐵酸鈉(Na2FeO4摩爾質量為166g/mol)等新型凈水劑替代傳統的凈水劑Cl2對淡水進行消毒是城市飲用水處理新技術.ClO2和Na2FeO4在水處理過程中分別被還原為Cl-和Fe3+.分析 (1)依據取1molClO2、Cl2、Na2FeO4,分別計算在氧化還原反應中元素化合價變化數目判斷解答;
(2)Na2FeO4把H2O氧化為O2,氧氣殺菌消毒,它本身被還原為Fe3+.Fe3+水解產生Fe(OH)3膠體吸附水中的懸浮物質.從而凈化了水,據此寫出反應的離子方程式;
(3)①甲醇與氯氣在水溶液中發生氧化還原反應生成氯化氫和二氧化碳;
②由①中的兩個反應方程式可以看出若轉移相同的電子,Cl-的消耗與產生量相等,結合催化劑的概念解答;
③將第一步與第二步的方程式疊加可得總方程式:6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O.將副反應ClO3-+Cl-+H+-Cl2↑+H2O配平可得:ClO3-+5Cl-+6H+=3Cl2↑+3H2O若測得反應后的混合氣體中Cl2的體積分數為3/73,假設氣體的總物質的量為73mol,則Cl2為3mol;CO2和ClO2總物質的量為70mol.產生3mol的Cl2消耗NaClO3的物質的量1mol;根據方程式6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O可知產生CO2和ClO2總物質的量為70mol消耗CH3OH的物質的量為10mol;消耗 NaClO3的物質的量為60mol,據此計算解答;
(4)①依據ClO2的沸點低,容易揮發的性質解答;
②C為尾氣吸收裝置,由于ClO2能與堿發生反應,所以通常用NaOH溶液來吸收,二者反應生成NaClO2、NaClO3、H2O.
解答 解:(1)ClO2、Na2FeO4、Cl2三種消毒殺菌劑的消毒效率分別是ClO2:67.5g÷5mol=13.5g/mol; Na2FeO4:166g÷3mol=55.33g/mol;Cl2:71g/2mol=35.5g/mol.所以三種消毒殺菌劑的消毒效率由大到小的順序是ClO2>Cl2>Na2FeO4;
故答案為:ClO2>Cl2>Na2FeO4;
(2)根據題意可得Na2FeO4把H2O氧化為O2,氧氣殺菌消毒,它本身被還原為Fe3+.Fe3+水解產生Fe(OH)3膠體吸附水中的懸浮物質.從而凈化了水.該反應的離子方程式為:4FeO42-+10 H2O=4Fe(OH)3+8OH-+3O2↑;
故答案為:4FeO42-+10 H2O=4Fe(OH)3+8OH-+3O2↑;
(3)①甲醇與氯氣在水溶液中發生氧化還原反應生成氯化氫和二氧化碳,所以第二步反應的離子方程式為:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
故答案為:CH3OH+3Cl2+H2O=6Cl-+CO2+6H+;
②由①中的兩個反應方程式可以看出若轉移相同的電子,Cl-的消耗與產生量相等.之所以在工業生產時要在反應物中加少量Cl-,是因為Cl-起作催化劑作用;
故答案為:催化劑;
③將第一步與第二步的方程式疊加可得總方程式:6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O.將副反應ClO3-+Cl-+H+-Cl2↑+H2O配平可得:ClO3-+5Cl-+6H+=3Cl2↑+3H2O若測得反應后的混合氣體中Cl2的體積分數為3/73,假設氣體的總物質的量為73mol,則Cl2為3mol;CO2和ClO2總物質的量為70mol.產生3mol的Cl2消耗NaClO3的物質的量1mol;根據方程式6ClO3-+CH3OH+6H+=CO2↑+6ClO2↑+5H2O可知產生CO2和ClO2總物質的量為70mol消耗CH3OH的物質的量為10mol;消耗 NaClO3的物質的量為60mol.所以共消耗CH3OH的物質的量為10mol;消耗 NaClO3的物質的量為60mol+3mol=61mol.因此起始投料時CH3OH與NaClO3的物質的量之比為10:61=1:6.1;
故答案為:1:6.1;
(4)①因為ClO2的沸點低,容易揮發,所以B部分還應補充的裝置是冷凝裝置.可以用冰水進行降溫;
故答案為:(冰水)冷凝;
②C為尾氣吸收裝置,由于ClO2能與堿發生反應,所以通常用NaOH溶液來吸收.反應的方程式為:2ClO2+2NaOH=NaClO2+NaClO3+H2O;
故答案為:2ClO2+2NaOH=NaClO2+NaClO3+H2O.
點評 本題考查飲用水的不同消毒劑的消毒效率的比較、ClO2的制法、性質及涉及的化學反應原理.主要包括氧化還原反應的化學方程式、離子方程式的配平、書寫、實驗裝置的選擇、應用和有關計算的知識,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿性溶液:Na+、Ca2+、SO42-、CO32- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | 氯水溶液:H+、Fe2+、SO42-、Cl- | |
| D. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
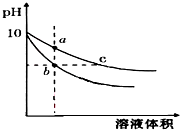 常溫下,相同pH的氫氧化鈉和醋酸鈉溶液加水稀釋,平衡時pH 隨溶液體積變化的曲線如圖所示,則下列敘述不正確的是( )
常溫下,相同pH的氫氧化鈉和醋酸鈉溶液加水稀釋,平衡時pH 隨溶液體積變化的曲線如圖所示,則下列敘述不正確的是( )| A. | b、c兩點溶液的導電能力不相同 | |
| B. | a、b、c三點溶液中水的電離程度a>c>b | |
| C. | 用相同濃度的鹽酸分別與等體積的b、c處溶液反應,消耗鹽酸體積Vb=Vc | |
| D. | c點溶液中C(H+)+C(CH3COOH)=C(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
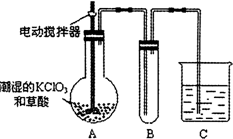
 煤的干餾是煤氣化的重要方法,也是煤綜合利用最“古老”的、最簡單的方法.某實驗小組根據教材習題設計了煤干餾實驗,裝置如圖所示.實驗時,取約2-3g的煤粒,在研體中研磨至粉末狀態;用藥匙將煤粉放入試管中,在具支試管中加入2mL水,按照如圖所示安裝好裝置;點燃酒精燈,對試管預熱后再集中受熱,待具支試管中氣泡產生的速度均勻后,在具支試管口收集氣體,并用明火靠近具支試管口,可以觀察到產生的氣體能夠燃燒.根據上述實驗回答下列問題:
煤的干餾是煤氣化的重要方法,也是煤綜合利用最“古老”的、最簡單的方法.某實驗小組根據教材習題設計了煤干餾實驗,裝置如圖所示.實驗時,取約2-3g的煤粒,在研體中研磨至粉末狀態;用藥匙將煤粉放入試管中,在具支試管中加入2mL水,按照如圖所示安裝好裝置;點燃酒精燈,對試管預熱后再集中受熱,待具支試管中氣泡產生的速度均勻后,在具支試管口收集氣體,并用明火靠近具支試管口,可以觀察到產生的氣體能夠燃燒.根據上述實驗回答下列問題: +HNO3$→_{△}^{濃硫酸}$
+HNO3$→_{△}^{濃硫酸}$ +H2O;
+H2O;
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
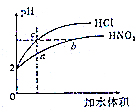 室溫下,體積和pH都相同的鹽酸和HNO2溶液加水稀釋時的pH變化曲線如圖所示,下列有關說法正確的是( )
室溫下,體積和pH都相同的鹽酸和HNO2溶液加水稀釋時的pH變化曲線如圖所示,下列有關說法正確的是( )| A. | 原HNO2溶液的濃度為0.01mol•L-1 | |
| B. | 溶液中水的電離程度:b>c | |
| C. | $\frac{c(N{{O}_{2}}^{-})}{c(HN{O}_{2})•c(O{H}^{-})}$比值:b>a | |
| D. | 等濃度的HNO2與NaOH溶液按體積比為2:1充分反應的混合液中,c(NO2-)+2c(OH-)=c(HNO2)+2c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
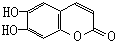 )具有抗癌作用.下列關于七葉樹內酯的敘述中不正確的是( )
)具有抗癌作用.下列關于七葉樹內酯的敘述中不正確的是( )| A. | 能被KMnO4酸性溶液氧化 | |
| B. | 既可以看成酚類化合物又可看成酯類化合物 | |
| C. | 能與銀氨溶液發生銀鏡反應 | |
| D. | 1 mol該物質最多與3 mol Br2 發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (CH3CH2)2CHCH3的正確命名是2-乙基丁烷 | |
| B. | 有機物大多是分子晶體,則乙醇的沸點和它相對分子質量相近的烷烴相差不多 | |
| C. | 鑒別淀粉、蛋白質、葡萄糖水溶液,依次可分別使用的試劑且對應的現象,碘水、變藍色;硫酸銅溶液,白色沉淀;新制Cu(OH)2,加熱后有磚紅色沉淀 | |
| D. | 驗證某有機物屬于烴,應完成的實驗內容是測定該試樣的質量及試樣完全燃燒后生成CO2和H2O的質量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com