
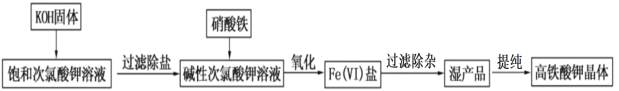
【題目】高鐵酸鉀在飲用水源和廢水處理過程中,不僅能去除污染物和致癌化學污染物,而且不產生任何誘變致癌的產物,具有高度的安全性;其可溶于水,微溶于濃 KOH 溶液,且在強堿性溶液中比 較穩定。實驗室用次氯酸鹽氧化法制備高鐵酸鉀(K2FeO4)的流程如圖所示:
流程圖中的飽和次氯酸鉀溶液的制備裝置如圖所示:
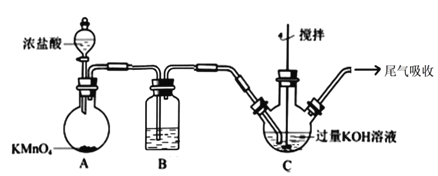
(1)A 為氯氣發生裝置。A 中反應的離子方程式是___________;裝置 B 內的試劑及作用是____________;
(2)裝置 C 反應溫度控制在 0~5℃進行,在不改變 KOH 溶液濃度前提下,實驗中可采取措施是________。
(3)流程圖中在加入 KOH 固體的時候會產生大量的白色沉淀_____(填化學式)。
(4)在攪拌下,將 Fe(NO3)3飽和溶液緩慢滴加到 KClO 飽和溶液中即可制取 K2FeO4,寫出該反應的離子方程式__________;反應過程中溫度控制在 10~15℃,溫度過低或過高對反應的影響是_____________。
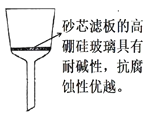
(5)過濾除雜時不用普通漏斗和濾紙而采用砂芯漏斗(如圖)的原因是_____________。
(6)在提純高鐵酸鉀時采用重結晶、洗滌、干燥的方法,洗滌劑可以選用_____。
A.H2O B.濃 KOH 溶液 C.Fe(NO3)3溶液 D.異丙醇
(7)若提純得到 a gK2FeO4(M=198g/mol),上述流程中有 5%的 Fe 損失,則需要提供 Fe(NO3)3(M=242g/mol)的質量為_____g(用含 a 的計算式表示)。
【答案】2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O 飽和食鹽水、吸收雜質HCl氣體 將C裝置置于冰水浴中冷卻 KCl 3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O 溫度過低或過高對反應的影響是溫度太低,反應速率慢影響產品的產率,溫度太高,會含有雜質,氧化劑的有效濃度降低,從而使反應速率和轉化率下降; 普通漏斗和濾紙在堿性條件下容易被腐蝕,而砂芯漏斗的濾板耐堿性和抗腐蝕性較好 BD ![]() g
g
【解析】
A裝置制備氯氣,B裝置除去氯氣中混有的HCl氣體,C裝置制備K2FeO4,尾氣吸收裝置吸收未反應的氯氣,防止污染空氣。
(1)A 為氯氣發生裝置,高錳酸鉀與濃鹽酸生成氯化錳和氯氣。A 中反應的離子方程式是2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;生成的氯氣中含有氯化氫,裝置 B 內的試劑是飽和食鹽水,作用是吸收HCl氣體;故答案為:2MnO4-+10Cl-+16H+=Mn2++5Cl2↑+8H2O;飽和食鹽水、吸收雜質HCl氣體;
(2)C裝置制備K2FeO4,反應溫度控制在 0~5℃進行,在不改變 KOH 溶液濃度前提下,實驗中可采取措施是將C裝置置于冰水浴中冷卻。故答案為:將C裝置置于冰水浴中冷卻;
(3)發生的反應方程式為2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O,KCl溶解度小,飽和后易析出,流程圖中在加入 KOH 固體的時候會產生大量的白色沉淀KCl。故答案為:KCl;
(4)在攪拌下,將 Fe(NO3)3飽和溶液緩慢滴加到 KClO 飽和溶液中即可制取 K2FeO4,在KOH溶液中,Fe(NO3)3與KClO應生成K2FeO4、KCl和KNO3,反應的方程式為:2 Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O,該反應的離子方程式3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;反應過程中溫度控制在 10~15℃,溫度過低或過高對反應的影響是溫度太低,反應速率慢,影響產品的產率,溫度太高,會含有雜質,氧化劑的有效濃度降低,從而使反應速率和轉化率下降。故答案為:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;溫度過低或過高對反應的影響是溫度太低,反應速率慢,影響產品的產率,溫度太高,會含有雜質,氧化劑的有效濃度降低,從而使反應速率和轉化率下降;
(5)過濾除雜時不用普通漏斗和濾紙而采用砂芯漏斗的原因是普通漏斗和濾紙在堿性條件下容易被腐蝕,而砂芯漏斗的濾板耐堿性和抗腐蝕性較好。故答案為:普通漏斗和濾紙在堿性條件下容易被腐蝕,而砂芯漏斗的濾板耐堿性和抗腐蝕性較好;
(6)K2FeO4可溶于水、微溶于濃KOH溶液,在異丙醇中溶解度也比較小,在提純高鐵酸鉀時采用重結晶、洗滌、干燥的方法,洗滌劑可以選用B.濃 KOH 溶液D.異丙醇;故答案為:BD。
(7)由鐵原子守恒:Fe(NO3)3~K2FeO4
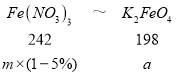
m=![]() g,故答案為:
g,故答案為:![]() g。
g。


科目:高中化學 來源: 題型:
【題目】我們利用物質的結構與性質對周期表進行研究,有助于我們更好地掌握同類知識。
(1)基態砷原子中,價電子占用__個原子軌道;雌黃分子式為As2S3,分子結構如圖,則砷原子的雜化方式為__。

(2)向CuSO4溶液中加入少量氨水生成藍色沉淀,繼續加入過量氨水沉淀溶解,得到深藍色透明溶液,最后向該溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶體;該晶體所含的非金屬元素中,N、O、S第一電離能由大到小的順序是__(填元素符號),SO42-的空間構型為__,晶體中含有的化學鍵有__。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶體的原因是__。
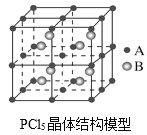
(3)常溫下PCl5是一種白色晶體,其立方晶系晶體結構模型如圖所示,由A、B兩種微粒構成。將其加熱至148℃熔化,形成一種能導電的熔體。已知A微粒與CCl4具有相同的空間構型和相似的化學鍵特征,則A為__,B為__。
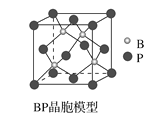
(4)磷化硼(BP)是一種超硬耐磨涂層材料,如圖為其立方晶胞。已知晶體中最近的硼原子和磷原子核間距為xcm,磷化硼的摩爾質量為bg·mol-1,阿伏加德羅常數為NA,則磷化硼晶體密度的表達式為__g·cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國秦俑彩繪和漢代器物上用的顏料被稱為“中國藍”、“中國紫”,直到近年來人們才研究出來其成分為BaCuSi4O10,BaCuSi2O6。
(1)“中國藍”、“中國紫”中均具有Cun+離子,n=___,基態時該陽離子的價電子排布式為______。
(2)“中國藍”的發色中心是以Cun+為中心離子的配位化合物,其中提供孤對電子的是___元素。
(3)合成“中國藍”、“中國紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶體中Si原子的雜化軌道是由______軌道(填軌道的名稱和數目)和________軌道雜化而成的。
(4)現代文物分析發現,“中國藍”中含有微量硫元素。假若硫元素來源一種陰離子是正四面體的天然鋇礦中,則最可能的鋇礦化學式是______。
(5)在5500年前,古代埃及人就己經知道如何合成藍色顏料—“埃及藍”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中國藍”一致。CO32一中鍵角∠OCO為___。根據所學,從原料分解的角度判斷“埃及藍”的合成溫度比“中國藍”更___(填“高”或“低”)。
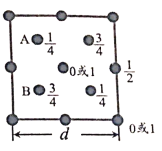
(6)自然界中的SiO2,硬度較大,主要原因是___。下圖為SiO2晶胞中Si原子沿z軸方向在xy平面的投影圖(即俯視投影圖),其中O原子略去,Si原子旁標注的數字表示每個Si原子位于z軸的高度,則SiA與SiB的距離是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學變化中的能量轉換對于生產具有重大意義和研究價值。回答下列問題:
(l)中科院大連化學物理研究所的科研人員在新型納米催化劑Na-Fe3O4和HMCM-22的表面將CO2轉化為烷烴,其過程如圖。

①過程Ⅰ能量__(填“釋放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJmol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJmol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJmol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(異戊烷,g) △H=+267.6kJmol-1。
則5CO(g)+11H2(g)═C5H12(異戊烷,g)+5H2O(g)△H=__kJmol-1。
(2)一種銅版畫雕刻用的酸性蝕刻液的有效成份是CuCl2,蝕刻反應為:Cu2++Cu+6Cl-═2CuCl32-。工業上用電解法將CuCl32-轉化為Cu2+,使蝕刻液再生并回收金屬Cu。裝置如圖(電極不參與反應)。

①再生的CuCl2蝕刻液為流出液__(填“a”或“b”)。
②寫出N極的電極反應:__。
③裝置中使用___離子交換膜(填“陽”或“陰”)。若電解池工作前,陰極室和陽極室中電解液質量相等,當轉移0.1mol電子,流出液未流出時,兩側電解液的質量差為__g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中學化學涉及多種常數。 下列說法正確的是
A.兩種物質反應,不管怎樣書寫化學方程式,平衡常數不變
B.對于反應:3A(g)+2B(g) 4C(s)+2D(g)的化學平衡常數表達式為 K= ![]()
C.KW 不是水的電離平衡常數
D.難溶電解質 AB2 飽和溶液中,c(A2+)=x mol·L-1,c(B-)=y mol·L-1,則 Ksp 值為 4xy2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以太陽能為熱源,熱化學硫碘循環分解水是一種高效、無污染的制氫方法,其流程如下圖所示。已知向反應中得到的產物中加過量I2會得到兩層溶液——含低濃度I2的H2SO4層和含高濃度I2的HI層,這兩層分別進行反應Ⅱ和Ⅲ,循環分解制氫。下列說法錯誤的是( )
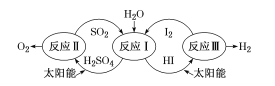
A.反應I的化學方程式為 SO2+2H2O+I2=H2SO4+2HI
B.該流程將太陽能轉化為化學能,且降低了水分解制氫的活化能
C.H2SO4層和HI層在加I2之前和加I2之后均分成兩層,且兩層密度、顏色均不相同
D.SO2和I2是反應 2H2O =2H2+O2的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳捕集與封存是應對氣候變化問題的解決方案之一。回答下列問題:
(l)我國科研團隊利用低溫等離子體協同催化技術,在常溫常壓下實現了將CO2和CH4一步轉化為化工產品。試寫出 CO2與CH4合成乙酸的熱化學方程式:____。
(甲烷和乙酸的燃燒熱分別為-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一鋼性密閉容器中CH4、CO2的分壓分別為15 kPa、20 kPa,加入Ni/α-Al2 O3催化劑并加熱至1123 K使其發生反應:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28![]() 10-2﹒p(CH4)
10-2﹒p(CH4)![]() p(CO2)(kPa
p(CO2)(kPa![]() s-1),某時刻測得p(H2)=10 kPa,則 p(CH4)=___kPa,v(CO)=___kPa
s-1),某時刻測得p(H2)=10 kPa,則 p(CH4)=___kPa,v(CO)=___kPa![]() s-1。
s-1。
②達到平衡后測得體系壓強是起始時的![]() ,則該反應的平衡常數Kp=____kPa)2。
,則該反應的平衡常數Kp=____kPa)2。
(3)氮化鎵(GaN)與Cu可組成如圖所示的人工光合系統,該裝置能以CO2和H2O為原料合成CH4。
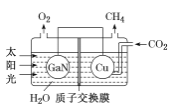
①該裝置工作時H+移向____(填“GaN”或“Cu”)電極,該電極上的電極反應式為 ___。
②該裝置每產生1 mol CH4,左極室溶液質量減少____g。
③本實驗條件下,若CO2轉化為烴(如甲烷、乙烯等)的轉化率為10%,生成CH4的選擇性為12%,現收集到12 mol CH4,則通入的CO2為____mol。(已知:選擇性=生成目標產物消耗的原料量/原料總的轉化量)
(4)上述人工光合系統裝置也可以制備乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面選擇加氫的反應機理,如下圖所示。其中吸附在Pd表面的物質用“*”標注。
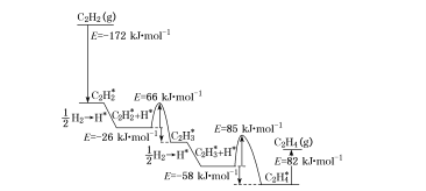
上述吸附反應為 ____填“吸熱”或“放熱”)反應,該過程中最小能壘(活化能)為___ kJ![]() mol-1,該步驟的化學方程式為____。
mol-1,該步驟的化學方程式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】萜類化合物廣泛存在于動植物體內,關于下列萜類化合物的說法正確的是( )

A. a和b都屬于芳香族化合物
B. a和c分子中所有碳原子均處于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能與新制的Cu(OH)2反應生成紅色沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是()
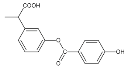
①分子式為C16H14O5 ②能使酸性高錳酸鉀溶液褪色 ③能發生加成反應,但不能發生取代反應 ④苯環上的一溴代物有6種 ⑤1mol 該有機物與NaOH反應時最多消耗4mol NaOH ⑥1mol該有機物在一定條件下和H2反應,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com