
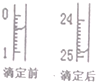
 想用0.1000mol•L-1NaOH溶液通過中和滴定測定鹽酸溶液的物質的量濃度,回答下列問題.
想用0.1000mol•L-1NaOH溶液通過中和滴定測定鹽酸溶液的物質的量濃度,回答下列問題.| 滴定序號 | 待測液體積(mL) | 所消耗NaOH標準液的體積(mL) | ||
| 滴定前 | 滴定后 | 消耗的體積 | ||
| 1 | 25.00 | x | y | z |
| 2 | 25.00 | 4.00 | 29.60 | 25.60 |
| 3 | 25.00 | 0.60 | 26.00 | 25.40 |
分析 (1)室溫時,Kw=1×10-14,0.1000mol•L-1NaOH溶液中c(OH-)=1×10-1mol/L,根據c(H+)=$\frac{Kw}{c(O{H}^{-})}$以及H2O?H++OH-計算;
(2)根據酸性溶液盛放在酸式滴定管中;
(3)根據溶液顏色變化且半分鐘內不變色,可說明達到滴定終點;
(4)根據滴定管的結構以及測量體積的原理來分析;
(5)先考慮數據的合理性,然后求體積的平均值,最后根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$計算;
(6)根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差.
解答 解:(1)室溫時,Kw=1×10-14,0.1000mol•L-1NaOH溶液中c(OH-)=1×10-1mol/L,根據c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-1}}$mol/L=1×10-13mol/L,又H2O?H++OH-,則由水電離的c(OH-)=c(H+)=1×10-13mol/L;
故答案為:1×10-13mol/L;
(2)待測液為鹽酸,顯酸性,滴定時用酸式滴定管將其移入錐形瓶中;
故答案為:酸式;
(3)酸溶液中滴加無色的酚酞,酚酞不變紅,用酚酞做指示劑,滴定達到終點的現象是:滴入最后一滴NaOH標準液,溶液由無色變為粉紅色,且半分鐘內不褪色;
故答案為:滴入最后一滴NaOH標準液,溶液由無色變為粉紅色,且半分鐘內不褪色;
(4)鹽酸是酸性溶液,存放在酸式滴定管中;滴定前讀數為:0.40mL,滴定后讀數為:24.90mL,消耗溶液的體積為24.50mL;
故答案為:24.50mL;
(5)第一次實驗誤差太大,舍去,求出第2組、第3組消耗的NaOH標準液的體積為25.50mL,c(待測)=$\frac{25.50×0.1000}{25.00}$mol/L=0.1020 mol/L,
故答案為:0.1020 mol/L;
(6)a.洗滌堿式滴定管時未用裝溶液潤洗,使氫氧化鈉溶液濃度偏小,造成V(標準)偏大,根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,故a正確;
b.洗滌時錐形瓶只用蒸餾水洗凈后而未潤洗,待測液的物質的量不變,V(標準)不變,所以c(待測)不變,故b錯誤;
c.讀所用標準液體積時,滴定前仰視,滴定后仰視,無法判斷V(標準)的變化,所以c(待測)無法判斷,故c錯誤;
d.滴定時標準液不小心滴入到錐形瓶外面,造成V(標準)偏大,根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,故d正確;
故選ad;
點評 本題考查中和滴定實驗、滴定管結構與使用、誤差分析、滴定計算等,難度不大,注意理解中和滴定的原理與滴定管的結構及精度.


科目:高中化學 來源: 題型:選擇題
| A. | 某特定反應的平衡常數只與溫度有關 | |
| B. | 催化劑不能改變平衡常數的大小 | |
| C. | 平衡常數發生改變,化學平衡必發生改變 | |
| D. | 化學平衡移動時,平衡常數必改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (NH4)2C2O4溶液中,c(NH4+)=2c(C2O42-) | |
| B. | 等物質的量濃度的氨水和H2C204溶液等體積混合,所得溶液呈堿性 | |
| C. | pH=11的氨水和pH=3的H2C204溶液等體積混合,所得溶液呈酸性 | |
| D. | 用H2C204溶液中和氨水至中性時,溶液中c(NH4+)=2c(C2O42-)+c(HC2O4-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 做過木炭還原氧化銅實驗的硬質玻璃管(鹽酸) | |
| B. | 長期存放氯化鐵溶液的試劑瓶(稀硫酸) | |
| C. | 做過碘升華實驗的試管(酒精) | |
| D. | 沾有油污的燒杯(純堿溶液) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | HA物質的量濃度/(mol•L-1) | NaOH物質的量濃度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{175}{176}$ | B. | $\frac{100}{99}$ | C. | $\frac{99}{100}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com