
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2011-2012學年湖南師大附中高三第四次月考化學試卷 題型:選擇題
下列反應的離子方程式正確的是( )
A.NaHSO3溶液中滴加過量的Ba(OH)2溶液:
2HSO1—2OH-Ba2+ BaSO3↓+SO32-+2H2O
BaSO3↓+SO32-+2H2O
B.新制的硫酸亞鐵溶液和過氧化氫溶液反應:Fe2++2H++H2O2 Fe3++2H2O
Fe3++2H2O
C.FeCl3溶液中滴加過量的氨水: Fe3++3NH2·H2O Fe(OH)3↓+3NH4+
Fe(OH)3↓+3NH4+
D.向100mL 3mol·L-1FeBr3溶液中通入標準狀況下3.36L Cl2:
2Fe2++4Br-+3Cl2 2Fe3++2Br2+6Cl-
2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
某校化學小組學生利用下圖所列裝置進行“鐵與水反應”的實驗,并利用產物進一步制取FeCl.3??6H2O晶體。(圖中夾持及尾氣處理裝置均已略去)
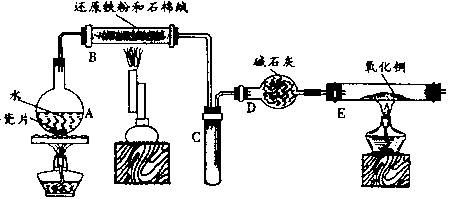
(1)裝置B中發生反應的化學方程式是_________________________ ______;
(2)反應前向A中放入碎瓷片的目的是_______________________________,裝置A、B、E、三處均需要加熱,A、B、E三處加熱的先后順序是(用A、B、E表示) ;
(3)停止反應,待B管冷卻后,取其中的固體,加入過量稀鹽酸充分反應,過濾。向濾液中加入KSCN溶液,溶液不顯紅色,說明濾液中不含有![]() 離子,你認為濾液中不含有
離子,你認為濾液中不含有![]() 離子可能的原因是:__________________________________________。
離子可能的原因是:__________________________________________。
(4)該小組利用(3)中濾液制取FeCl3??6H2O晶體設計流程如下:
![]()
①步驟I若向100mL濾液中通入224mL Cl2(標準狀況下)恰好完全反應,則原濾液中金屬離子濃度約為__________mol/L。
②步驟II從FeCl3稀溶液中得到FeCl3·6H2O晶體的主要操作包括:
_______________________________________________________________。
③該流程中需保持鹽酸過量,主要原因是(結合必要的離子方程式簡要說明)
__________________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com