
| A. | 若Ⅰ達平衡時,A、B、C各增加1mol,則C轉化率將一定增大 | |
| B. | 若向Ⅰ平衡體系中在加入1molA和3molB,C的體積分數若大于x,可斷定n>3 | |
| C. | 若Ⅱ體系起始物質的量滿足9a+c=3b,則可判斷n=3 | |
| D. | 若n=2,則Ⅱ體系起始物質的量應滿足2a+1<b<3 |
分析 在恒溫恒容的密閉容器中,將1molA和3molB在一定條件下反應,達平衡時C的體積分數為x,若起始時A、B、C投入的物質的量分別為a、b、c,平衡時C的體積分數也為x,二者應為等效平衡,應存在a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,以此解答該題.
解答 解:在恒溫恒容的密閉容器中,將1molA和3molB在一定條件下反應,達平衡時C的體積分數為x,若起始時A、B、C投入的物質的量分別為a、b、c,平衡時C的體積分數也為x,二者應為等效平衡,應存在a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,
A.由于n值不確定,則若Ⅰ達平衡時,A、B、C各增加1mol,B的轉化率不能確定,故A錯誤;
B.因容器體積不變,若x=3時,C的體積分數應為x,現大于x,x應小于3,促進平衡正向移動,故B錯誤;
C.由恒溫恒容時,當a、b、c為起始物質的量,平衡時C的體積分數仍為x,a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,若n=3,二者聯式可得9a+c=3b,故C正確;
D.由恒溫恒容時,當a、b、c為起始物質的量,平衡時C的體積分數仍為x,a+$\frac{1}{n}$c=1,b+$\frac{2}{n}$c=3,若n=2,二者聯式可得b=2a+1,故D錯誤;
故選C.
點評 本題考查化學平衡,題目難度較大,注意從等效平衡的角度解答該題,易錯點為A,注意n不確定,A、B、C各增加1mol,B的轉化率可能增加,也可能不變.


科目:高中化學 來源: 題型:選擇題
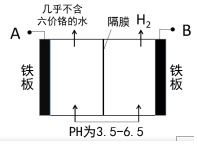 某工廠采用電解法處理含鉻廢水,耐酸電解槽用鐵板作陰、陽極,槽中盛放含鉻廢水,工業設備如圖所示,下列說法不正確的是( )
某工廠采用電解法處理含鉻廢水,耐酸電解槽用鐵板作陰、陽極,槽中盛放含鉻廢水,工業設備如圖所示,下列說法不正確的是( )| A. | A接電源正極 | |
| B. | 陽極區溶液中發生的氧化還原反應為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O | |
| C. | 陰極區附近溶液pH減小 | |
| D. | 若不考慮氣體的溶解,當收集到H2 13.44L時(標況),有0.1mol Cr2O72-被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol NaH參加反應失去1mol電子 | B. | 每生成1mol H2轉移2mol電子 | ||
| C. | NaH既是氧化劑,又是還原劑 | D. | NaOH是氧化產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
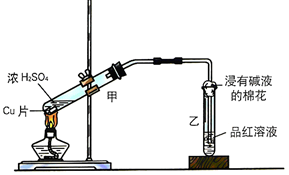
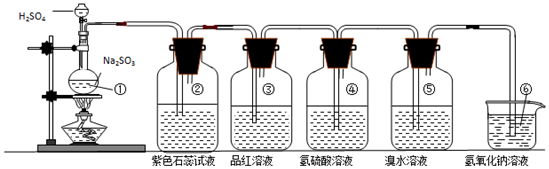
| 裝置序號 | 實驗現象或作用 | 實驗結論或化學方程式 |
| ① | 有氣泡產生 | 化學方程式為:Na2SO3+H2SO4(濃)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊試液變紅色 | 證明SO2溶于水顯酸性 |
| ③ | 品紅溶液褪色 | 證明SO2具有漂白性 |
| ④ | 溶液變渾濁 | 證明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 證明SO2具有還原性 |
| ⑥ | 吸收尾氣 | 證明SO2屬于酸性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+,Cl-,MnO4-,SO42- | B. | Na+,SiO32-,NO3-,CO32- | ||
| C. | Na+,NO3-,SO42-,HCO3- | D. | Na+,SO42-,S2-,ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 62g白磷(白磷P4為正四面體結構P原子位于頂點)中含P-P共價鍵為6NA | |
| B. | 1molCl2全部發生反應時,無論什么時候都是得到的電子數一定為2NA | |
| C. | 若一個CO的質量為a g,則CO的摩爾質量為a NA | |
| D. | 常溫下10LpH=13的NaOH溶液中含有的OH-離子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,NA個H2O 分子所占體積約為22.4L | |
| B. | 0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2組成的混合氣體在標準狀況下的體積約為22.4 L | |
| C. | 常溫常壓下,2.24 L CO和CO2混合氣體中含有的碳原子數目為0.1 NA | |
| D. | 0.5mol/L的NaCl溶液中Cl-的個數為是0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
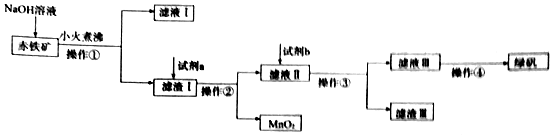
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com