
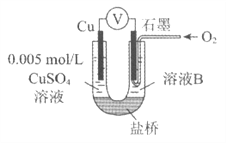
【題目】某小組同學利用原電池裝置探究物質的性質。
資料顯示:原電池裝置中,負極反應物的還原性越強,或正極反應物的氧化性越強,原電池的電壓越大。
(1)同學們利用下表中裝置進行實驗并記錄。
裝置 | 編號 | 電極A | 溶液B | 操作及現象 |
| I | Fe | pH=2的 H2SO4 | 連接裝置后,石墨表面產生無色氣泡;電壓表指針偏轉 |
Ⅱ | Cu | pH=2的 H2SO4 | 連接裝置后,石墨表面無明顯現象;電壓表指針偏轉,記錄讀數為a |
①同學們認為實驗I中鐵主要發生了析氫腐蝕,其負極反應式是__________。
②針對實驗Ⅱ現象:甲同學認為不可能發生析氫腐蝕,其理論判斷依據是__________;
乙同學認為實驗Ⅱ中應發生吸氧腐蝕,其正極的電極反應式是__________。
(2)同學們仍用上述裝置并用Cu和石墨為電極繼續實驗,探究實驗Ⅱ指針偏轉原因及影響O2氧化性的因素。
編號 | 溶液B | 操作及現象 |
Ⅲ | 經煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆蓋,連接裝置后,電壓表指針微微偏轉,記錄讀數為b |
Ⅳ | pH=2的H2SO4 | 在石墨一側緩慢通入O2并連接裝置,電壓表指針偏轉,記錄讀數為c;取出電極,向溶液中加入數滴濃Na2SO4溶液混合后,插入電極,保持O2通入,電壓表讀數仍為c |
V | pH=12的NaOH | 在石墨一側緩慢通入O2并連接裝置,電壓表指針偏轉,記錄讀數為d |
①丙同學比較實驗II、Ⅲ、Ⅳ的電壓表讀數為:c>a>b,請解釋原因是__________。
②丁同學對Ⅳ、V進行比較,其目的是探究__________對O2氧化性的影響。
③實驗Ⅳ中加入Na2SO4溶液的目的是__________。
④為達到丁同學的目的,經討論,同學們認為應改用下圖裝置對Ⅳ、V重復進行實驗,其設計意圖是__________;重復實驗時,記錄電壓表讀數依次為c'、d',且c'>d',由此得出的結論是__________。
【答案】 Fe—2e-=Fe2+ 在金屬活動性順序中,Cu在H后,Cu不能置換出H2 O2+4H++4e-=2H2O O2濃度越大,其氧化性越強,使電壓值增大 溶液的酸堿性 排除溶液中的Na+(或SO42-)對實驗的可能干擾 排除Cu在酸堿性不同的溶液中,其還原性不同對該實驗結果的影響 溶液酸性越強,O2的氧化性越強(介質或環境的pH影響物質的氧化性)
【解析】分析:(1).①.I中的鐵主要發生析氫腐蝕,鐵在負極失電子發生氧化反應;②.銅與氫離子不能發生自發的氧化還原反應;乙同學認為實驗Ⅱ中應發生吸氧腐蝕,則在正極上氧氣得電子發生還原反應生成水;(2). ①.實驗Ⅱ、Ⅲ、IV的電解質相同,不同的是氧氣的濃度,出現了電壓表讀數不同,根據數值的相對大小可知,氧氣濃度越大,電壓表的讀數越高;②.實驗Ⅳ、V是利用電解質溶液的酸堿性不同,來判斷電壓表的指針偏轉情況;③.實驗IV中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)對實驗的可能干擾;④.為達到丁同學的目的,經討論,同學們認為應改用如圖裝置對IV、V重復進行實驗,其設計意圖是排除Cu在酸堿性不同的溶液中,其還原性不同對該實驗結果的影響;重復實驗時,記錄電壓表讀數依次為c'、d',且c'>d',說明溶液酸性越強,O2的氧化性越強。
詳解:(1). ①. I中的鐵主要發生析氫腐蝕,則鐵在負極失電子發生氧化反應,電極反應式為:Fe-2e-=Fe2+,故答案為:Fe-2e-=Fe2+;
②. 在金屬活動性順序中,Cu在H的后面,銅與氫離子不能發生自發的氧化還原反應;乙同學認為實驗Ⅱ中應發生吸氧腐蝕,則在正極上氧氣得電子發生還原反應生成水,其正極的電極反應式是O2+4H++4e-=2H2O,故答案為:在金屬活動性順序中,Cu在H后,Cu不能置換出H2;O2+4H++4e-=2H2O;
(2). ①. 實驗Ⅱ、Ⅲ、IV的電解質相同,不同的是氧氣的濃度,出現了電壓表讀數不同,根據數值的相對大小可知,氧氣濃度越大,電壓表的讀數越高,所以O2濃度越大,其氧化性越強,使電壓值增大,故答案為:O2濃度越大,其氧化性越強,使電壓值增大;
②. 在實驗Ⅳ、V中是利用溶液的酸堿性不同來判斷電壓表的指針偏轉情況,所以Ⅳ、V進行比較,其目的是探究溶液的酸堿性對O2氧化性的影響,故答案為:溶液的酸堿性;
③. 實驗IV中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)對實驗的可能干擾,故答案為:排除溶液中的Na+(或SO42-)對實驗的可能干擾;
④. 為達到丁同學的目的,經討論,同學們認為應改用如圖裝置對Ⅳ、V重復進行實驗,其設計意圖是排除Cu在酸堿性不同的溶液中,其還原性不同對該實驗結果的影響;重復實驗時,記錄電壓表讀數依次為c'、d',且c'>d',由此得出的結論是溶液酸性越強,O2的氧化性越強,故答案為:排除Cu在酸堿性不同的溶液中,其還原性不同對該實驗結果的影響;溶液酸性越強,O2的氧化性越強(介質或環境的pH影響物質的氧化性)。


科目:高中化學 來源: 題型:
【題目】以冶鋁的廢棄物鋁灰為原料制取超細α氧化鋁,既降低環境污染又可提高鋁資源的利用率。已知鋁灰的主要成分為Al2O3(含少量雜質SiO2、FeO、Fe2O3),其制備實驗流程如下圖:
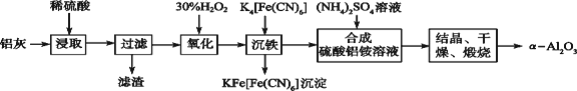
(1)寫出鋁灰與氫氧化鈉溶液反應涉及的化學方程式:_______________________。
(2)加30%H2O2溶液發生的離子反應方程式為______________________________。
(3)煅燒硫酸鋁銨晶體,發生的主要反應為:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,將產生的氣體通過下圖所示的裝置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,將產生的氣體通過下圖所示的裝置。
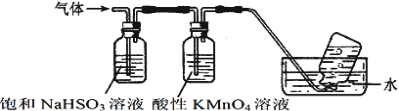
集氣瓶中收集到的氣體是_______(填化學式)。
②酸性KMnO4溶液紫色變淺_______(填“能”或“不能”)說明煅燒硫酸鋁銨晶體產物中含有SO2氣體?理由:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組設計實驗驗證以下規律:元素的非金屬性越強,對應的最高價氧化物的水化物酸性就越強。該小組設計了如圖裝置進行實驗。擬比較C、Si、S三種元素的非金屬性。
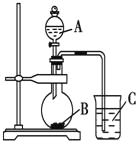
(1)推測三種元素對應的最高價氧化物的水化物酸性由強到弱的順序是_________________(填化學式)。
(2)若B、C均為正鹽,且焰色反應均為黃色。A、B、C的化學式依次為_________、__________、_________(A、C填溶質的化學式)。
(3)燒瓶中的實驗現象為________________________________。
(4)固體B也可以用B的溶液代替。實驗室配制0.1mol/L的B的溶液450mL,需要用托盤天平稱取B_____g。
(5)有同學認為,將A中物質換為濃硝酸,其余試劑不變。則可以驗證N、C、Si三元素的非金屬性強弱。你認為,該同學的觀點___________(選填“正確”“錯誤”)。理由是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語正確的是( )
A. 硫離子的結構示意圖:![]()
B. 明礬的化學式:KAlSO412H2O
C. 亞硫酸的電離方程式:H2SO3=2H++SO32﹣
D. 質子數為17、中子數為20的氯原子:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】迷迭香酸是從蜂花屬植物中提取得到的酸性物質,其結構如圖。下列敘述正確的是( )
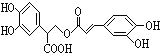
A. 迷迭香酸屬于芳香烴
B. 迷迭香酸含有五種官能團
C. 1mol迷迭香酸最多能和7mol溴水發生反應
D. 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相對位置如圖(甲不一定在丁、庚的連線上),戊、己分別是空氣、地殼中含量最多的元素。下列判斷錯誤的是 ( )
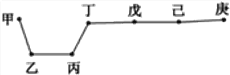
A. 甲可能是金屬元素
B. 氣態氫化物的穩定性:庚>己>戊
C. 丙與戊的最高價氧化物的水化物可以相互反應
D. 庚的最高價氧化物的水化物酸性最強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法中不正確的是( )
A.工業上可利用海水制取鎂
B.從海產品(如海帶等)中提取碘是工業上獲取碘的重要途徑
C.工業上可通過鋁土礦獲得鋁
D.工業上用CO氧化赤鐵礦(含Fe2O3)獲得鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】V2﹣、W3﹣、X2+、Y2﹣、Z﹣是由短周期元素形成的簡單離子,其中V2﹣、W3﹣、X2+均是10電子的微粒,Y2﹣、Z﹣與Ar原子具有相同的電子數。(請用化學用語回答下列問題)
(1)V2﹣的離子結構示意圖為_________________。
(2)V、W、X的原子半徑由小到大的順序是________________。
(3)元素Y、Z氣態氫化物的熱穩定性比較(填化學式):______________。
(4)將Z的單質通入石蕊溶液中發生的顏色變化如下圖,請在方框內填寫出導致該階段顏色變化的主要粒子符號。________、________、________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某一化學反應中,反應物B的濃度在5 s內從2.0 mol/L變成0.5 mol/L,在這5 s內B的化學反應速率為
A. 0.3B. 0.3 mol/(L·s)
C. 0.4 mol(L·s)-1D. 0.04 mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com