
【題目】某研究性學習小組設計實驗驗證以下規(guī)律:元素的非金屬性越強,對應的最高價氧化物的水化物酸性就越強。該小組設計了如圖裝置進行實驗。擬比較C、Si、S三種元素的非金屬性。
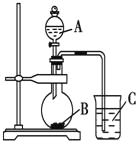
(1)推測三種元素對應的最高價氧化物的水化物酸性由強到弱的順序是_________________(填化學式)。
(2)若B、C均為正鹽,且焰色反應均為黃色。A、B、C的化學式依次為_________、__________、_________(A、C填溶質的化學式)。
(3)燒瓶中的實驗現(xiàn)象為________________________________。
(4)固體B也可以用B的溶液代替。實驗室配制0.1mol/L的B的溶液450mL,需要用托盤天平稱取B_____g。
(5)有同學認為,將A中物質換為濃硝酸,其余試劑不變。則可以驗證N、C、Si三元素的非金屬性強弱。你認為,該同學的觀點___________(選填“正確”“錯誤”)。理由是__________________。
【答案】H2SO4、H2CO3、H2SiO3(H4SiO4也可,有大于符合也可) H2SO4 Na2CO3 Na2SiO3 有氣泡產(chǎn)生(或有氣體生成)(強調無色氣體也可;說到氣味算錯) 5.3 錯誤 硝酸揮發(fā)到C中,不能確定與Na2SiO3反應的是碳酸(答到揮發(fā)性,或者硝酸與Na2SiO3反應均可)
【解析】
元素的非金屬性越強,其最高價含氧酸的酸性越強,由圖可知應是利用最高價含氧酸的酸性強弱比較,利用強酸制弱酸原理分析,則
(1)元素的非金屬性越強,其最高價含氧酸的酸性越強;
(2)若B、C均為正鹽,且焰色反應均為黃色,則為鈉鹽,即碳酸鈉與硅酸鈉,據(jù)此分析作答;
(3)燒瓶內(nèi)為硫酸制碳酸的過程,會有二氧化碳生成;
(4)容量瓶有固定的規(guī)格;根據(jù)m = cVM計算即可;
(5)硝酸易揮發(fā)。
(1)C、Si、S的非金屬性從大到小為:S > C > Si,所以其最高價含氧酸的酸性由強到弱的順序為:H2SO4、H2CO3、H2SiO3(H4SiO4也可,有大于符合也可),
故答案為:H2SO4、H2CO3、H2SiO3(H4SiO4也可,有大于符合也可);
(2)有上述分析可知,B為碳酸鈉,C為硅酸鈉,A為S元素對應最高價氧化物的水化物硫酸,所以其化學式分別為:H2SO4;Na2CO3;Na2SiO3,
故答案為:H2SO4;Na2CO3;Na2SiO3;
(3)根據(jù)強酸制弱酸的原理,可知,燒瓶內(nèi)硫酸會與碳酸鈉反應生成二氧化碳、硫酸鈉與水,所以其實驗現(xiàn)象為:生成氣體(或有氣體生成);
故答案為:生成氣體(或有氣體生成);
(4)容量瓶的規(guī)格只有500 mL,所以所配制的B溶液的溶質為Na2CO3,其質量為m = cVM = 0.1 mol/L×500×10-3 L×106 g/mol = 5.3 g,
故答案為:5.3 g;
(5)硝酸揮發(fā)到C中,不能確定與Na2SiO3反應的是碳酸,因此不能驗證N、C、Si三元素的非金屬性強弱,
故答案為:錯誤;驗證N、C、Si三元素的非金屬性強弱。


科目:高中化學 來源: 題型:
【題目】某有機物A的相對分子質量為62。為進一步測定A 的化學式,取3.1g A完全燃燒,得到二氧化碳和水蒸氣。將產(chǎn)物先后通過足量的濃硫酸和堿石灰,兩者分別增重2.7 g和4.4 g(假設每步反應完全)。
(1)該有機物的實驗式是__________________;分子式是________________。
(2)紅外光譜顯示有“C—C”鍵和“O—H”鍵的振動吸收,若核磁共振氫譜只有2個吸收峰且峰面積之比為1∶2,推斷該有機物的結構簡式是__________________。
(3)該有機物與金屬鈉反應的化學方程式是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種元素,其中A元素和B元素的原子都有1個未成對電子,A+比B-少一個電子層,B原子得一個電子填入3p軌道后,3p軌道已充滿;C原子的p軌道中有3個未成對電子,其氣態(tài)氫化物在水中的溶解度在同族元素所形成的氫化物中最大;D的最高化合價和最低化合價的代數(shù)和為4,其最高價氧化物中含D的質量分數(shù)為 40%,且其核內(nèi)質子數(shù)等于中子數(shù)。化合物R是由A、D兩元素形成的離子化合物,其中A+陽離子與Dn-陰離子數(shù)之比為2∶1。請回答下列問題:
(1)B-的電子排布式為______________,在CB3分子中C元素原子的原子軌道發(fā)生的是______雜化。
(2)C的氫化物的空間構型為________________,其氫化物在同族元素所形成的氫化物中沸點最高的原因是__________________________________________________________。
(3)B元素的電負性____D元素的電負性(填“>”、“<”或“=”),用一個化學方程式說明B、D兩元素形成的單質的氧化性強弱:________________________________。
(4)如圖所示是R形成的晶體的晶胞,設晶胞的棱長為a cm。 試計算R晶體的密度為_________________。(阿伏加德羅常數(shù)用NA表示)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 毒膠囊和老酸奶事件說明化學試劑對食品的危害,我們應該拒絕一切化學試劑的使用
B. 興建更多的鋼鐵、水泥企業(yè),提高鋼鐵、水泥的產(chǎn)量
C. 日本核泄漏造成的核輻射事故暴露出核能應用潛在的巨大危險,應立即停建核電站
D. 開發(fā)新能源,減小含碳化合物的使用,降低碳的排放
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硅及其化合物在材料領域中應用廣泛。下列敘述正確的是( )
A. 用帶玻璃瓶塞的試劑瓶盛放NaOH溶液
B. 硅是地殼中含量最多的元素
C. SiO2不溶于水也不溶于任何酸
D. 晶體硅是良好的半導體材料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在3個體積均為1 L的恒容密閉容器中發(fā)生反應:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改變?nèi)萜鱅的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
2NO2(g)+S(s)。改變?nèi)萜鱅的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
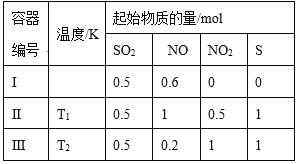
A. 若T2<T1,達到平衡時,容器Ⅲ中NO的體積分數(shù)小于40%
B. 該反應的ΔH>0
C. T1時,該反應的平衡常數(shù)為![]()
D. 容器Ⅰ與容器Ⅱ均在T1時達到平衡,總壓強之比小于1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
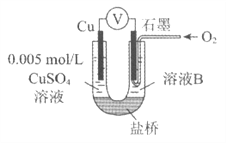
【題目】某小組同學利用原電池裝置探究物質的性質。
資料顯示:原電池裝置中,負極反應物的還原性越強,或正極反應物的氧化性越強,原電池的電壓越大。
(1)同學們利用下表中裝置進行實驗并記錄。
裝置 | 編號 | 電極A | 溶液B | 操作及現(xiàn)象 |
| I | Fe | pH=2的 H2SO4 | 連接裝置后,石墨表面產(chǎn)生無色氣泡;電壓表指針偏轉 |
Ⅱ | Cu | pH=2的 H2SO4 | 連接裝置后,石墨表面無明顯現(xiàn)象;電壓表指針偏轉,記錄讀數(shù)為a |
①同學們認為實驗I中鐵主要發(fā)生了析氫腐蝕,其負極反應式是__________。
②針對實驗Ⅱ現(xiàn)象:甲同學認為不可能發(fā)生析氫腐蝕,其理論判斷依據(jù)是__________;
乙同學認為實驗Ⅱ中應發(fā)生吸氧腐蝕,其正極的電極反應式是__________。
(2)同學們?nèi)杂蒙鲜鲅b置并用Cu和石墨為電極繼續(xù)實驗,探究實驗Ⅱ指針偏轉原因及影響O2氧化性的因素。
編號 | 溶液B | 操作及現(xiàn)象 |
Ⅲ | 經(jīng)煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆蓋,連接裝置后,電壓表指針微微偏轉,記錄讀數(shù)為b |
Ⅳ | pH=2的H2SO4 | 在石墨一側緩慢通入O2并連接裝置,電壓表指針偏轉,記錄讀數(shù)為c;取出電極,向溶液中加入數(shù)滴濃Na2SO4溶液混合后,插入電極,保持O2通入,電壓表讀數(shù)仍為c |
V | pH=12的NaOH | 在石墨一側緩慢通入O2并連接裝置,電壓表指針偏轉,記錄讀數(shù)為d |
①丙同學比較實驗II、Ⅲ、Ⅳ的電壓表讀數(shù)為:c>a>b,請解釋原因是__________。
②丁同學對Ⅳ、V進行比較,其目的是探究__________對O2氧化性的影響。
③實驗Ⅳ中加入Na2SO4溶液的目的是__________。
④為達到丁同學的目的,經(jīng)討論,同學們認為應改用下圖裝置對Ⅳ、V重復進行實驗,其設計意圖是__________;重復實驗時,記錄電壓表讀數(shù)依次為c'、d',且c'>d',由此得出的結論是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產(chǎn)中可用雙氧水氧化法處理電鍍含氰廢水,某化學興趣小組模擬該法探究有關因素對破氰反應速率的影響(注:破氰反應是指氧化劑將CN-氧化的反應)。
【相關資料】
①氰化物主要是以CN-和[Fe(CN)6]3-兩種形式存在。
②Cu2+可作為雙氧水氧化法破氰處理過程中的催化劑;Cu2+在偏堿性條件下對雙氧水分解影響較弱,可以忽略不計。
③[Fe(CN)6]3-較CN-難被雙氧水氧化,且pH越大,[Fe(CN)6]3-越穩(wěn)定,越難被氧化。
【實驗過程】
在常溫下,控制含氰廢水樣品中總氰的初始濃度和催化劑Cu2+的濃度相同,調節(jié)含氰廢水樣品不同的初始pH和一定濃度雙氧水溶液的用量,設計如下對比實驗:
(1)請完成以下實驗設計表(表中不要留空格)。
實驗序號 | 實驗目的 | 初始pH | 廢水樣品體積/mL | CuSO4溶液的體積/mL | 雙氧水溶液的體積/mL | 蒸餾水的體積/mL |
① | 為以下實驗操作參考 | 7 | 60 | 10 | 10 | 20 |
② | 廢水的初始pH對破氰反應速率的影響 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
實驗測得含氰廢水中的總氰濃度(以CN-表示)隨時間變化關系如圖所示。
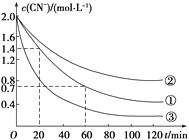
(2)實驗①中20~60 min時間段反應速率:v(CN-)=______mol·L-1·min-1。
(3)實驗①和實驗②結果表明,含氰廢水的初始pH增大,破氰反應速率減小,其原因可能是____________________(填一點即可)。在偏堿性條件下,含氰廢水中的CN-最終被雙氧水氧化為HCO,同時放出NH3,試寫出該反應的離子方程式:____________。
(4)該興趣小組同學要探究Cu2+是否對雙氧水氧化法破氰反應起催化作用,請你幫助他們設計實驗并驗證上述結論,完成下表中內(nèi)容(已知:廢水中的CN-濃度可用離子色譜儀測定) ______。
實驗步驟(不要寫出具體操作過程) | 預期實驗現(xiàn)象和結論 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com