
【題目】環己烯是重要的化工原料。其實驗室制備流程如下:
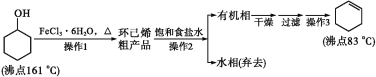
回答下列問題:
Ⅰ.環己烯的制備與提純
(1)原料環己醇中若含苯酚雜質,檢驗試劑為__________,現象為____________。
(2)操作1的裝置如圖所示(加熱和夾持裝置已略去)。
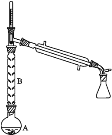
①燒瓶A中進行的可逆反應化學方程式為__________________________________,濃硫酸也可作該反應的催化劑,選擇FeCl3·6H2O而不用濃硫酸的原因為___________(填序號)。
a.濃硫酸易使原料炭化并產生SO2
b.FeCl3·6H2O污染小、可循環使用,符合綠色化學理念
c.同等條件下,用FeCl3·6H2O比濃硫酸的平衡轉化率高
②儀器B的作用為____________________________。
(3)操作2用到的玻璃儀器是__________________________。
Ⅱ.環己烯含量的測定
在一定條件下,向a g環己烯樣品中加入定量制得的b mol Br2,與環己烯充分反應后,剩余的Br2與足量KI作用生成I2,用c mol·L-1的Na2S2O3標準溶液滴定,終點時消耗Na2S2O3標準溶液V mL(以上數據均已扣除干擾因素)。
測定過程中,發生的反應如下:
①Br2+![]() →
→![]()
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(4)滴定所用指示劑為__________________________。樣品中環己烯的質量分數為______________________(用字母表示)。
(5)下列情況會導致測定結果偏低的是__________________(填序號)。
a.樣品中含有苯酚雜質
b.在測定過程中部分環己烯揮發
c.Na2S2O3標準溶液部分被氧化
【答案】FeCl3溶液 溶液顯紫色 ![]()
![]()
![]() +H2O a、b 減少環己醇蒸出 分液漏斗、燒杯 淀粉溶液
+H2O a、b 減少環己醇蒸出 分液漏斗、燒杯 淀粉溶液  ×100% b、c
×100% b、c
【解析】
環己醇發生消去反應生成環己烯和水,環己烯不溶于水,飽和食鹽水溶解環己醇、氯化鐵,然后分液得到的水相中含有環己醇、氯化鐵,得到的有機相中含有環己烯,然后干燥、過濾、蒸餾得到環己烯。
Ⅰ.(1)苯酚能和氯化鐵溶液發生顯色反應;
(2)①燒瓶A中進行的可逆反應為環己醇的消去反應;濃硫酸具有強氧化性,能氧化原料,且FeCl36H2O污染小、可循環使用;
②儀器B能冷凝回流環己醇;
(3)操作2分離互不相溶的液體;
Ⅱ.(4)碘與淀粉變藍;根據消耗碘單質的量可知環己烯的物質的量,然后結合m=nM計算樣品中環己烯的質量分數;
(5)a.苯酚消耗的溴的物質的量偏大;
b.苯酚環己烯揮發,導致消耗的溴偏少,測定結果偏低;
c.Na2S2O3標準溶液部分被氧化,標準液消耗的體積增大。
環己醇發生消去反應生成環己烯和水,環己烯不溶于水,飽和食鹽水溶解環己醇、氯化鐵,然后分液得到的水相中含有環己醇、氯化鐵,得到的有機相中含有環己烯,然后干燥、過濾、蒸餾得到環己烯。
Ⅰ.(1)苯酚能和氯化鐵溶液發生顯色反應,所以可以用FeCl3溶液檢驗苯酚,苯酚和氯化鐵溶液混合溶液呈紫色;
(2)①燒瓶A中環己醇發生消去反應生成環己烯和水,該反應方程式為![]()
![]()
![]() +H2O;由于濃硫酸具有強氧化性,易使原料炭化并產生SO2,從而降低環己烯產率,而FeCl36H2O污染小、可循環使用,符合綠色化學理念,所以選擇FeCl36H2O而不用濃硫酸,答案選a、b;
+H2O;由于濃硫酸具有強氧化性,易使原料炭化并產生SO2,從而降低環己烯產率,而FeCl36H2O污染小、可循環使用,符合綠色化學理念,所以選擇FeCl36H2O而不用濃硫酸,答案選a、b;
②儀器B能冷凝回流環己醇,所以B的作用是減少環己醇蒸出,增大環己醇利用率;
(3)操作2用于分離互不相溶的液態,操作方法為分液,需要的玻璃儀器有分液漏斗、燒杯;
Ⅱ.(4)根據反應原理,反應中產生碘單質,碘與淀粉變藍,則指示劑可選用淀粉溶液;在一定條件下,向a g環己烯樣品中加入定量制得的bmolBr2,與環己烯充分反應后,剩余的Br2與足量KI作用生成I2,用c mol·L-1的Na2S2O3標準溶液滴定,終點時消耗Na2S2O3標準溶液V mL,根據反應①Br2+![]() →
→![]() ,②Br2+2KI=I2+2KBr,③I2+2Na2S2O3=2NaI+Na2S4O6,剩余Br2~ I2~2Na2S2O3,則剩余的溴單質物質的量=
,②Br2+2KI=I2+2KBr,③I2+2Na2S2O3=2NaI+Na2S4O6,剩余Br2~ I2~2Na2S2O3,則剩余的溴單質物質的量= ![]() c mol·L-1×V×10-3L=
c mol·L-1×V×10-3L=![]() mol,消耗的溴的物質的量=(b-
mol,消耗的溴的物質的量=(b-![]() )mol,由反應①可得,環己烯的物質的量=(b-
)mol,由反應①可得,環己烯的物質的量=(b-![]() )mol, 樣品中環己烯的質量分數=
)mol, 樣品中環己烯的質量分數= ×100%=
×100%= ×100%;
×100%;
(5)a.樣品中含有苯酚雜質,苯酚和溴發生取代反應生成三溴苯酚,導致消耗的Br2的物質的量偏大,計算結果偏高,故a不符合題意;
b.在測定過程中部分環己烯揮發導致環己烯質量減少,導致測定結果偏低,故b符合題意;
c.Na2S2O3標準溶液部分被氧化,標準液消耗的體積增大,導致消耗碘的物質的量偏大,則測定的剩余溴單質的偏大,環己烯的量偏小,計算結果偏低,故c符合題意。


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源: 題型:
【題目】氫原子是最輕的原子,人們曾預言它可能是所有元素之母。碳是地球上組成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氫和______。基態碳原子的核外電子占有______個原子軌道。
(2)光化學煙霧中除了含有 NOx 外,還含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的雜化方式有______。1mol PAN 中含有的σ鍵數目為______。組成PAN 的元素的電負性大小順序為______。
②相同壓強下,HCOOH 的沸點比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。請畫出 H5O2 的結構式:______。
(4)硅和碳在同一主族。下圖為 SiO2 晶胞中 Si 原子沿 z 軸方向在 xy 平面的投影圖(即俯視圖),其 中 O原子略去,Si 原子旁標注的數字表示每個 Si 原子位于 z 軸的高度,則 SiA 與 SiB 之間的距離是______nm。
 (d 的單位為 nm)
(d 的單位為 nm)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學院長春應用化學研究所在甲醇(CH3OH)燃料電池方面獲得新突破,研制出了自呼吸電池及主動式電堆。甲醇燃料電池的工作原理如圖所示。(已知:質子交換膜的作用是只允許H+通過;甲醇在氧氣中燃燒生成CO2和H2O。)

(1)該電池工作時,b處通入的物質為__,c處通入的物質為___。
(2)該電池負極的電極反應式為__。
(3)該電池工作一段時間后,當12.8g甲醇完全反應時,有___mol電子發生轉移。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列熱化學方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各問:
(1)上述反應中屬于放熱反應的是___________。
(2)C的燃燒熱為_________________。
(3)燃燒10g H2生成液態水,放出的熱量為_________________。
(4)CO燃燒的熱化學方程式為 ________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質與NaOH醇溶液共熱完全反應后,可得3種有機物的是( )
A.CH3﹣CHCl﹣CH2﹣CH3
B.
C.CH3﹣C(CH3)Cl﹣CH2﹣CH3
D.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第三代永磁體材料——釹鐵硼(NdFeB)因其優異的綜合磁性能,被廣泛應用于計算機、通信信息等高科技產業。
(1)鐵、鈷、鎳元素性質非常相似,原子半徑接近但依次減小,NiO、FeO的晶體結構類型與氯化鈉相同。基態鈷原子價電子軌道表示式為_______,熔沸點:NiO_____FeO(填“<”“>”或“=”)。
(2)FeSO4·(NH4)2SO4·6H2O俗稱摩爾鹽,相對于FeSO4·7H2O而言,摩爾鹽不易失水,不易被空氣氧化,在化學分析實驗中常用于配制Fe(Ⅱ)的標準溶液,硫酸亞鐵銨晶體中亞鐵離子穩定存在的原因是______________________。
(3)新型儲氫材料氨硼烷(NH3BH3)常溫下以固體穩定存在,極易溶于水。
①氨硼烷分子中B原子采取_________雜化。
②氨硼烷晶體中存在的作用力有范德華力、極性鍵、_______和_________。
(4)氨硼烷受熱析氫的過程之一如圖1所示。
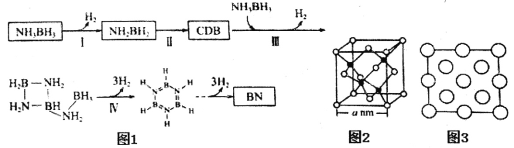
①NH2BH2的氮硼鍵鍵能大于NH3BH3,其原因為__________________________。
②CDB的結構簡式為___________________________。
③立方氮化硼(BN)晶體的晶胞結構如圖2所示。阿伏伽德羅常數值為NA,該晶體的密度為_______g·cm-3(用含a和NA的最簡式表示)。圖3是立方氮化硼晶胞的俯視投影圖,請在圖中用“●”標明B原子的相對位置_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某廠廢水中含KCN,其濃度為0.01 mol·L-1,現用氯氧化法處理,發生如下反應(化合物中N化合價均為-3價):
KCN+2KOH+Cl2===KOCN+2KCl+H2O
(1)上述反應中被氧化的元素是________(用元素符號表示)。
(2)投入過量液氯,可將氰酸鹽進一步氧化為氮氣,請配平下列化學方程式:______________
______KOCN+______Cl2+______![]() ===______K2CO3+______N2+______KCl+______
===______K2CO3+______N2+______KCl+______![]()
(3)若將10 L含KCN的濃度為0.01 mol·L-1的廢水中KCN氧化除去,最少需要氯氣________ mol。
Ⅱ.某實驗小組為了測定(3)中溶液多余Cl2的含量,常用Na2S2O3標準溶液進行定量測定。
(4)現實驗室需用480 mL一定濃度的Na2S2O3溶液,配制該溶液所需玻璃儀器除燒杯、量筒、玻璃棒、膠頭滴管外,還需________。
(5)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO![]() ,因此Na2S2O3常用作脫氯劑,該反應的離子方程式為_________________。
,因此Na2S2O3常用作脫氯劑,該反應的離子方程式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】L-多巴是一種有機物,分子式為C9H11O4N,它可用于帕金森病的治療,其結構簡式為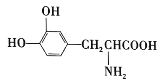 。下列關于L-多巴的敘述不正確的是( )
。下列關于L-多巴的敘述不正確的是( )
A.它屬于α-氨基酸,既具有酸性,又具有堿性
B.它能與FeCl3溶液發生顯色反應
C.它可以通過兩分子間縮合形成分子式為C18H18O6N2的化合物,該化合物中有3個六元環
D.它既與酸反應又與堿反應,等物質的量的L-多巴最多消耗的NaOH與HC1的物質的量之比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.能量之間可相互轉化:電解食鹽水制備氯氣是將電能轉化為化學能,而原電池可將化學能轉化為電能。設計兩種類型的原電池,探究其能量轉化效率。
限選材料:ZnSO4(aq),FeSO4 (aq),CuSO4 (aq);銅片,鐵片,鋅片和導線
(1)完成原電池甲的裝置示意圖,并作相應的標注。要求:在同一燒杯中,電極與溶液含相同的金屬元素。_____________
(2)以銅片為電極之一,硫酸銅溶液為電解質溶液,只在一個燒杯中組裝原電池乙,工作一段時間后,可觀察到負極________________
(3)甲乙兩種原電池中可更有效地將化學能轉化為電能的是____________,其原因是_________________________
(4)根據犧牲陽極的陰極保護法原理,為了減緩電解質溶液中鐵片的腐蝕,在上述的材料中應選__________作陽極。
Ⅱ. CO與H2反應還可制備C2H5OH,C2H5OH可作為燃料使用,用C2H5OH和O2組合形成的質子交換膜燃料電池的結構示意圖如下:
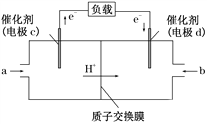
電池總反應為C2H5OH+3O2===2CO2+3H2O,則d電極是________(填“正極”或“負極”),c電極的反應方程式為_______________________________。若線路中轉移2 mol電子,則上述燃料電池,消耗的O2在標況下的體積為______ L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com