
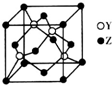
 X、Y、Z為前四周期元素,且原子序數依次增大.X與氫元素可形成:H2X、H2X2兩種化合物,且在常溫下均為液態;Y基態原子的M層電子數是K層的3倍;Z2+的3d軌道中有10個電子.請回答下列問題:
X、Y、Z為前四周期元素,且原子序數依次增大.X與氫元素可形成:H2X、H2X2兩種化合物,且在常溫下均為液態;Y基態原子的M層電子數是K層的3倍;Z2+的3d軌道中有10個電子.請回答下列問題:分析 X、Y、Z為前四周期元素且原子序數依次增大.X與氫元素可形成:H2X、H2X2兩種化合物,且在常溫下均為液態,則Y為O元素,形成的兩種化合物為H2O、H2O2;Y基態原子的M層電子數是K層的3倍,則M層電子數為6,故Y為S元素;Z2+的3d軌道中有10個電子,Z原子核外電子數為2+8+18+2=30,故Z為Zn,據此解答.
解答 解:X、Y、Z為前四周期元素且原子序數依次增大.X與氫元素可形成:H2X、H2X2兩種化合物,且在常溫下均為液態,則Y為O元素,形成的兩種化合物為H2O、H2O2;Y基態原子的M層電子數是K層的3倍,則M層電子數為6,故Y為S元素;Z2+的3d軌道中有10個電子,Z原子核外電子數為2+8+18+2=30,故Z為Zn.
(1)同周期隨原子序數增大,第一電離能呈增大趨勢,X(O元素)所在周期中第一電離能最大的主族元素是F元素;H2O2分子結構式為H-O-O-H,分子中O原子價層電子對數為2+$\frac{6-1×2}{2}$=4,故O原子的雜化方式是sp3雜化,故答案為:F;sp3;
(2)①SO42-中S原子價層電子對數為4+$\frac{6+2-2×4}{2}$=4,沒有孤電子對,故為正四面體構型,故答案為:正四面體;
②原子總數相同、價電子總數相同的微粒互為等電子體,故與SO42-互為等電子體分子為CCl4等,故答案為:CCl4等;
(3)[Zn(NH3)4]Cl2中Zn2+與NH3形成4個配位鍵,NH3中含有3個N-H鍵,均為σ鍵,故1mol[Zn(NH3)4]Cl2含有(4+3×4)mol=16molσ鍵,則含有σ鍵的數目為16NA,故答案為:16NA;
(4)晶胞中S原子數目為4,Zn原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞質量為4×$\frac{32+65}{{N}_{A}}$g,晶體的密度為a g•cm-3,則該晶胞的體積為:(4×$\frac{32+65}{{N}_{A}}$g)÷a g•cm-3=$\frac{388}{a{N}_{A}}$cm3,故答案為:$\frac{388}{a{N}_{A}}$cm3.
點評 本題是對物質結構的考查,涉及核外電子排布、電離能、雜化理論、分子構型、等電子體、化學鍵、晶胞計算等,難度中等,(3)為易錯點,學生容易忽略配位鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 向漂白粉中滴入60%的硫酸,產生黃綠色氣體,說明硫酸具有還原性 | |
| B. | 實驗室中將海帶中的I-完全氧化為I2時,宜選用H2O2作氧化劑而不用HNO3 | |
| C. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能轉化為BaCO3沉淀 | |
| D. | 25℃時,100mLpH=13的Ba(OH)2溶液中OH-的物質的量為0.02 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
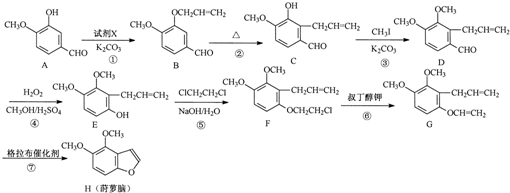
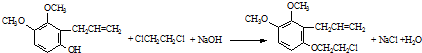 .
.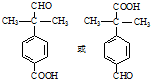 .
.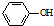 為原料制備
為原料制備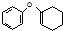 的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等濃度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室溫下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO4、H2SO4、H3PO4的酸性依次增強 | |
| B. | HCl、HBr、HI的穩定性依次增強 | |
| C. | 鈉、鎂、鋁的還原性依次減弱 | |
| D. | P、S、Cl最高正價依次降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化劑 | B. | 還原劑 | C. | 催化劑 | D. | 反應物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X與Y形成化合物時,X可能顯負價,也可能顯正價 | |
| B. | 第一電離能X可能小于Y | |
| C. | X的最高價含氧酸的酸性強于Y的最高價含氧酸的酸性 | |
| D. | 原子序數X一定大于Y |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com