
| A. | 標準狀況下,22.4LH2O含有分子數為1NA | |
| B. | 常溫常壓下,224LH2和O2的混合氣體所含分子數為NA | |
| C. | 通常狀況下,1molCl2與足量Na反應轉移電子數為NA | |
| D. | 常溫下,2.7g鋁與足量的鹽酸反應,失去的電子數為0.3NA |
分析 A.標準狀況下,水的狀態不是氣體;
B.常溫常壓下,不能使用標準狀況下的氣體摩爾體積計算;
C.1mol氯氣與鈉完全反應得到2mol電子;
D.鋁為+3價金屬,根據n=$\frac{m}{M}$計算出鋁的物質的量,然后計算出失去電子的物質的量.
解答 解:A.標準狀況下水不是氣體,不能使用標準狀況下的氣體摩爾體積計算,故A錯誤;
B.不是標準狀況下,不能使用標準狀況下的氣體摩爾體積計算混合氣體的物質的量,故B錯誤;
C.1molCl2與足量Na反應生成2mol氯化鈉,轉移2mol電子,轉移的電子數為2NA,故C錯誤;
D.2.7gAl的物質的量為:$\frac{2.7g}{27g/mol}$=0.1mol,0.1molAl完全反應失去0.3mol電子,失去的電子數為0.3NA,故D正確;
故選D.
點評 本題考查阿伏加德羅常數的有關計算和判斷,題目難度中等,明確標準狀況下的氣體摩爾體積的使用條件為解答關鍵,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,試題有利于培養學生的邏輯推理能力,提高學生靈活運用基礎知識解決實際問題的能力.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:推斷題
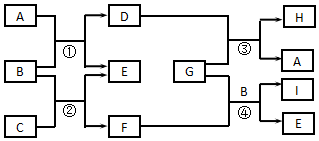
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 溶液中一定存在Mg2+和SO42- | |
| B. | 一定不存在Fe2+、Ba2+和CO32- | |
| C. | Cl-可能存在 | |
| D. | 必須通過焰色反應來確定溶液中是否存在K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.67 | B. | 0.75 | C. | 0.80 | D. | 1.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HA是一種弱酸 | |
| B. | 0.1 mol•L-1 HA溶液與0.05 mol•L-1 NaOH溶液等體積混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) | |
| C. | 體積、濃度均相等的HA溶液與鹽酸溶液分別與足量鋅反應,產生氫氣質量相同 | |
| D. | 該HA溶液中:2c(H+)=c(OH-)+c(A-)+c(HA) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
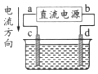
| A. | a 為負極、b 為正極 | B. | a 為陽極、b 為陰極 | ||
| C. | 電解過程中,d 電極質量增加 | D. | 電解過程中,氯離子濃度不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
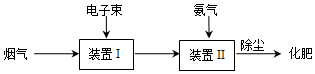
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28g N2含有的原子數為NA | |
| B. | 標準狀況下22.4L水中含有的H20分子數為NA | |
| C. | 6.5gZn均足量鹽酸反應失去的電子數為0.2NA | |
| D. | 2mol•L-1NaCl溶液中含有Na+個數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s內的平均反應速率υ(CO2)=3.75×10-4mol•L-1•s-1 | |
| B. | 使用催化劑可以提高單位時間內CO和NO的處理量 | |
| C. | 若將容積縮小為原來的一半,CO平衡轉化率大于25% | |
| D. | 若溫度降低,該反應的平衡常數增大,則該反應的△H>0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com