
250 mL pH=12的某一元強堿(MOH)溶液與250 mL 0.025 mol·L-1的硫酸溶液相混合,假設混合后液體體積為500 mL.
試求:(1)混合液的pH;
(2)若原250 mL一元強堿中含溶質0.1 g,則M的相對原子質量為多少?
(3)若給混合液中分別滴入幾滴甲基橙、無色酚酞、紫色石蕊試液,則溶液的顏色分別是什么?
科目:高中化學 來源:廣東省中山一中2012屆高三上學期第三次統測化學試題 題型:058
2011年8月12日,網上傳云南曲靖市越州鎮有總量5000余噸的重毒化工廢料鉻渣由于非法丟放,毒水被直接排放南盤江中.
Ⅰ:某工廠對制革工業污泥中Cr(Ⅲ)回收與再利用工藝如下(硫酸浸取液中金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
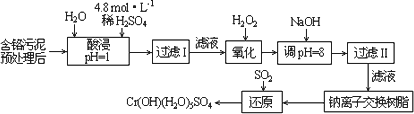
部分陽離子常溫下以氫氧化物形式沉淀時溶液的pH見下表:
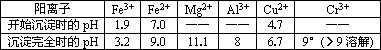
(1)實驗室用18.4 mol·L-1的濃硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃儀器除燒杯、玻璃棒和吸量管(一種能精確量取一定體積液體的儀器)外,還需________.
(2)酸浸時,為了提高浸取率可采取的措施是________(至少答一點).
(3)加入H2O2的作用是________.
調節溶液的pH=8是為了除去________離子.
(4)鈉離子交換樹脂的原理為:Mn++nNaR→MRn+nNa+,被交換的的雜質離子是________.
(5)還原過程發生以下反應(請配平):
________Na2Cr2O7+________SO2+________=________Cr(OH)(H2O)5SO4+________Na2SO4;
Ⅱ:
工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人類及生態系統產生很大損害,必須進行處理.其中一種處理方法為電解法:該法用Fe做電極,電解含Cr2O72-的酸性廢水,隨著電解進行,陰極附近溶液pH升高,產生Cr(OH)3沉淀.陽極的電極反應式為________.在陰極附近溶液pH升高的原因是(用電極反應方程式解釋)________.查看答案和解析>>
科目:高中化學 來源:山東省萊蕪一中2011屆高三上學期期末復習診斷性測試(二)化學試題 題型:013
|
設阿伏加德羅常數的數值為NA,下列說法正確的是 | |
| [ ] | |
A. |
250 mL 2 mol·L-1的氨水中含有NH3·H2O的分子數為0.5NA |
B. |
0.1 mol鐵在0.1 mol Cl2中充分燃燒,轉移的電子數為0.2NA |
C. |
22.4 L SO2氣體,所含氧原子數為2NA |
D. |
t℃時,pH=6的純水中含有OH-的個數為10-6NA |
查看答案和解析>>
科目:高中化學 來源:上海市虹口區2013年高考一模化學試題 題型:038
鐵是一種典型的過渡金屬,鐵和鐵的化合物在生產和生活中有廣泛的應用.完成下列計算∶
1.將11.802 g鋼樣粉末(只含鐵和碳)于高溫下置于足量的純氧中充分反應,冷卻后得到16.240 g磁性氧化鐵.
(1)鋼樣中含鐵________g.
(2)生成的CO2在標準狀況下體積為________mL.
2.向10 mL氯化鐵溶液(含鹽酸0.001 mol)中加入16.8 g 5%的燒堿溶液(足量),充分反應后過濾.洗滌沉淀,將洗滌液與濾液合并后稀釋至250 mL.取25 mL稀釋液,用0.100 mol/L鹽酸滴定,終點時消耗鹽酸的體積15.50 mL.計算原溶液中Fe3+的物質的量濃度.
3.鐵銹的主要成分實為羥基氧化鐵[化學式FeO(OH)].將一塊帶銹鐵片放入700 mL pH=0的稀硝酸中充分反應,收集到標準狀況下NO氣體3.584 L,最終剩余2.020 g鐵.求∶
(1)反應后溶液中溶質的成分與物質的量.
(2)原帶銹鐵片中鐵銹的質量分數.
4.用FeSO4和NaOH制備Fe(OH)2時,往往會形成一種灰綠色的中間物(用X表示).經分析,X中含有三種陰離子與兩種陽離子,陰、陽離子的總質量之比為11∶12.已知兩種陽離子為Fe2+與Fe3+,物質的量之比為2∶1.請通過計算確定X的化學式.
查看答案和解析>>
科目:高中化學 來源:上海市嘉定區2013年高考一模化學試題 題型:058
某同學進行試驗探究時,欲配制1.0 molL-1 Ba(OH)2溶液,但只找到在空氣中暴露已久的Ba(OH)2·8H2O試劑(化學式量:315).在室溫下配制溶液時發現所取試劑在水中僅部分溶解,燒杯中存在大量未溶物.
為探究原因,該同學查得Ba(OH)2·8H2O部分溶解度數據,見下表:
1.燒杯中未溶物僅為BaCO3,理由是________.
2.假設試劑由大量Ba(OH)2·8H2O和少量BaCO3組成,設計試驗方案,進行成分檢驗,在答題紙上寫出實驗步驟、預期現象和結論.(不考慮結晶水的檢驗;室溫時BaCO3飽和溶液的pH=9.6)限選試劑及儀器:稀鹽酸、稀硫酸、NaOH溶液、澄清石灰水、pH計、燒杯、試管、帶塞導氣管、滴管

3.將試劑初步提純后,準確測定其中Ba(OH)2·8H2O的含量.
實驗如下:①配制250 mL 約0.1 mol·L-1Ba(OH)2·8H2O溶液:準確稱取w克試樣,置于燒杯中,加適量蒸餾水,攪拌,將溶液轉入________,洗滌,定容,搖勻.②滴定:準確量取25.00 ml所配制Ba(OH)2溶液于錐形瓶中,滴加指示劑,將________(填“0.020”、“0.05”、“0.1980”或“1.5”)molL-1鹽酸裝入50 ml酸式滴定管,滴定至終點,記錄數據.重復滴定2次.平均消耗鹽酸Vml.
4.室溫下,________(填“能”或“不能”) 配制1.0 mol·L-1Ba(OH)2溶液,說明理由________.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com