
【題目】鐵、鋁、銅三種金屬元素在日常生活中的應用最為廣泛。回答下列問題:
(1)基態Fe原子的簡化電子排布式為__________。
(2)常溫下,Fe(CO)5為黃色液體,易溶于非極性溶劑。寫出CO的電子式_________;Fe(CO)5分子中σ鍵與π鍵之比為_______。
(3)硝酸銅溶于氨水形成[Cu(NH3)4](NO3)2的深藍色溶液。
①[Cu(NH3)4](NO3)2中陰離子的立體構型是_______。NO3-中心原子的軌道雜化類型為________。
②與NH3互為等電子體的一種陰離子為_______(填化學式);氨氣在一定的壓強下,測得的密度比該壓強下理論密度略大,請解釋原因________。
(4)金屬晶體可看成金屬原子在三維空間中堆積而成,單質鋁中鋁原子采用銅型模式堆積,原子空間利用率為74%,則鋁原子的配位數為________________。
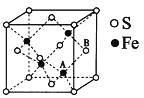
(5)鐵和硫形成的某種晶胞結構如圖所示,晶胞參數a=xpm,則該物質的化學式為_______;A原子距離B原子所在立方體側面的最短距離為______pm(用x表示);該晶胞的密度為____g·cm-3。(阿伏加德羅常數用NA表示)
【答案】[Ar] 3d64s2 ![]() 1:1 平面三角形 sp2 CH3- NH3通過氫鍵形成“締合”分子,分子間作用力增強,分子間距離減小,導致密度反常增大 12 FeS 0.25x
1:1 平面三角形 sp2 CH3- NH3通過氫鍵形成“締合”分子,分子間作用力增強,分子間距離減小,導致密度反常增大 12 FeS 0.25x ![]()
【解析】
(1)基態Fe原子的簡化電子排布式結合電子排布規律,按要求書寫;
(2) 應用等電子體原理書寫一氧化碳電子式;求出Fe(CO)5分子中σ鍵與π鍵,即可求比值;
(3)①通過價層電子對互斥理論,求出價電子對數即可知道[Cu(NH3)4](NO3)2中陰離子的立體構型以及NO3-中心原子的軌道雜化類型;
②應用等電子體原理,找出與NH3互為等電子體的一種陰離子;氨氣在一定的壓強下,測得的密度比該壓強下理論密度略大,結合密度的定義,以及氨氣的結構特點來分析;
(4)單質鋁中鋁原子采用銅型模式堆積,從銅型模式堆積的結構特點找出鋁原子的配位數;
(5)已知鐵和硫形成的某種晶胞結構,用均攤法計算晶胞內原子的數目,從而求出該物質的化學式,結合A原子的位置,從而確定A距離B原子所在立方體側面的最短距離;該晶胞的密度可以通過計算該晶胞的質量以及晶胞的體積求得;
(1) Fe原子序數為26,按電子排布規律,基態Fe原子的簡化電子排布式為[Ar] 3d64s2;
答案為:[Ar] 3d64s2 ;
(2) 氮氣和一氧化碳為等電子體,故它們的結構相似、電子式相似,一氧化碳電子式為![]()
![]() ; Fe(CO)5分子中σ鍵與π鍵均為10個,即可求比值為1:1;
; Fe(CO)5分子中σ鍵與π鍵均為10個,即可求比值為1:1;
答案為:![]() ; 1:1 ;
; 1:1 ;
(3)①通過價層電子對互斥理論,求出NO3-價電子對數為![]() ,即可知道[Cu(NH3)4](NO3)2中陰離子NO3-的立體構型為平面三角形,NO3-中心原子的軌道雜化類型sp2;
,即可知道[Cu(NH3)4](NO3)2中陰離子NO3-的立體構型為平面三角形,NO3-中心原子的軌道雜化類型sp2;
答案為:平面三角形;sp2 ;
②應用等電子體原理,找出與NH3互為等電子體的一種陰離子,應具有相同價電子數和原子數,CH3-滿足條件;
答案為:CH3-;
NH3通過氫鍵形成“締合”分子,分子間作用力增強,分子間距離減小,故體積偏小質量偏大,導致在一定的壓強下氨氣密度反常增大;
答案為:NH3通過氫鍵形成“締合”分子,分子間作用力增強,分子間距離減小,導致密度反常增大;
(4)單質鋁中鋁原子采用銅型模式堆積,即為面心立方堆積結構,則鋁原子的配位數為12;
答案為:12 ;
(5)已知鐵和硫形成的某種晶胞結構,鐵原子在晶胞內,有4個,硫原子在頂點和面心,用均攤法計算晶胞內S原子的數目=![]() ,鐵硫原子數目比1:1,從而求出該物質的化學式為FeS;
,鐵硫原子數目比1:1,從而求出該物質的化學式為FeS;
答案為:FeS;
根據晶胞示意圖,A原子位于小立方體的中心,把晶胞均分為八個小立方體,它距離B原子所在立方體側面的最短距離為晶胞邊長的四分之一,則A原子距離B原子所在立方體側面的最短距離為0.25x;
答案為:0.25x;
該晶胞的密度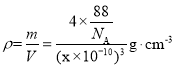 ,即密度為
,即密度為![]() g·cm-3;
g·cm-3;
答案為:![]() 。
。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】已知某有機物A的核磁共振氫譜如圖M1-1所示,下列說法中,錯誤的是
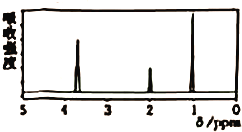
A. 若A的分子式為![]() ,則其結構簡式為
,則其結構簡式為![]()
B. 由核磁共振氫譜可知,該有機物分子中有三種不同化學環境的氫原子,且個數之比為1:2:3
C. 僅由其核磁共振氫譜無法得知其分子中的氫原子總數
D. 若A的化學式為![]() ,則其同分異構體有3種
,則其同分異構體有3種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)圖甲為晶體的二維平面示意圖,所表示物質的化學式可能為AX2的是______(填“a”或“b”)。
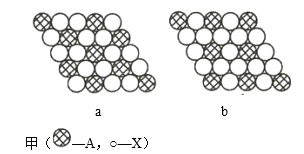
(2)圖乙為金屬銅的晶胞示意圖,請回答下列問題。
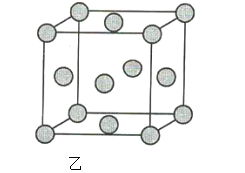
①該晶胞實際含有的銅原子數是______。
②該晶胞稱為______(填序號)。
A.六方晶胞 B.體心立方晶胞 C.面心立方晶胞 D.簡單立方晶胞
③該晶胞的邊長為a cm, Cu的摩爾質量為64g·mol-1,金屬銅的密度為pg·cm-3,則阿伏加德羅常數為___(用含a、p的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】活性氧化鋅(ZnO)廣泛用于橡膠、涂料、陶瓷、電子等行業,以粗氧化鋅(主要成分為ZnO,還含有少量MnO、CuO、FeO、Fe2O3等)為原料經深度凈化可制備高純活性氧化鋅,其流程如圖所示:
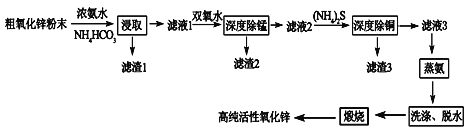
幾種難溶物的Ksp:
物質 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)將大小為66nm的高純活性氧化鋅粉末分散到水中,所得分散系為______。
(2)“浸取”過程中ZnO與NH3·H2O、NH4HCO3反應生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,則在該轉化反應中參加反應的NH3·H2O和NH4HCO3物質的量之比的最大值為___________(已知:1≤n≤4)。
(3)“深度除錳”過程中雙氧水可將“濾液1”中的Mn(OH)2轉化為更難溶的MnO2·H2O,寫出反應的化學方程式______________,“濾渣2”中存在的物質除了MnO2·H2O還可能含有_________(用化學式表示)。
(4)“深度除銅”過程中當溶液中![]() ≤2.0×10-6時,才能滿足“深度除銅”的要求,若溶液中Zn2+濃度為1mol/L時,則最終溶液中S2-的濃度理論上的最小值為____mol/L。
≤2.0×10-6時,才能滿足“深度除銅”的要求,若溶液中Zn2+濃度為1mol/L時,則最終溶液中S2-的濃度理論上的最小值為____mol/L。
(5)“蒸氨”過程中Zn[(NH3)n]CO3分解為ZnCO3·2Zn(OH)2·H2O、NH3和CO2。為了提高經濟效益,請設計循環利用NH3和CO2方案_____________。
(6)“煅燒”時ZnCO3·2Zn(OH)2轉變為高純活性氧化鋅,寫出反應的化學方程式______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于苯乙烯(![]() )的下列敘述:①能使酸性KMnO4溶液褪色,②可發生加聚反應,③可溶于水,④可溶于苯中,⑤苯環能與溴水發生取代反應,⑥所有的原子可能共面。其中完全正確的是( )
)的下列敘述:①能使酸性KMnO4溶液褪色,②可發生加聚反應,③可溶于水,④可溶于苯中,⑤苯環能與溴水發生取代反應,⑥所有的原子可能共面。其中完全正確的是( )
A.①②④⑥B.①②④⑤⑥C.①②④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下面的反應路線及所給信息,回答下列問題:
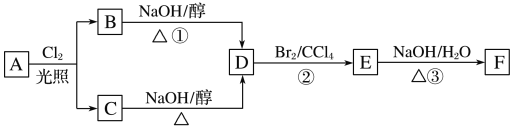
(1)標準狀況下的氣態烴A11.2L在氧氣中充分燃燒可以產生66gCO2和36gH2O,則A分子式的是__________。
(2)B和C均為一氯代烴,它們的名稱(系統命名)分別為__________。
(3)D的結構簡式為________________。
(4)E的一個同分異構體的結構簡式是________。(寫一個即可)
(5)①、②、③的反應類型依次是_______。
(6)寫出③反應的化學方程式:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向1L 0.1mol·L1一元酸HR溶液中逐漸通入氨氣(已知常溫下NH3·H2O電離平衡常數K=1.76×10-5),使溶液溫度和體積保持不變,混合溶液的pH與離子濃度變化的關系如圖所示。下列敘述正確的是
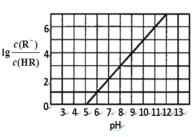
A.當c(R-)=c(HR)時,溶液必為中性
B.0.1mol·L-1HR溶液的pH為5
C.HR為弱酸,常溫時隨著氨氣的通入,![]() 逐漸增大
逐漸增大
D.當通入0.1 mol NH3時,c(NH4+)>c(R-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫是重要而潔凈的能源。要利用氫氣作為能源,必須解決好儲存氫氣的問題。化學家研究出利用合金儲存氫氣的方法,其中鑭(La)鎳(Ni)合金是一種儲氫材料,這種合金的晶體結構已經測定,其基本結構單元如圖所示,則該合金的化學式可表示為( )
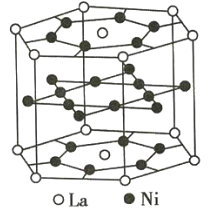
A.LaNi5B.LaNiC.La14Ni24D.La7Ni12
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com