
| 容器 | 容積/L | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
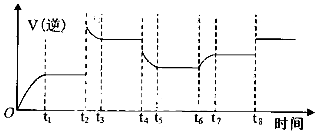
分析 (1)從表中數據可知,甲乙兩容器中反應物濃度相同,乙達到平衡時H2(g)的平衡量比甲的一半小,則T2對T1平衡逆向移動,由已知該反應正向為吸熱反應,則T2對T1是降低溫度,說明T2溫度低;
(2)根據Qc和K之間的大小關系來判斷;
(3)當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,據此解答,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態;
(4)該反應是一個反應前后氣體體積增大的且是正反應是吸熱的化學反應,t2時逆反應速率增大,且平衡時反應速率大于t2時反應速率,平衡向逆反應方向移動,t8時反應速率增大,但平衡不移動,根據外界條件對化學反應速率的影響來分析解答.
解答 解:(1)從表中數據可知,甲乙兩容器中反應物濃度相同,乙達到平衡時H2(g)的平衡量比甲的一半小,則T2對T1平衡逆向移動,由已知該反應正向為吸熱反應,則T2對T1是降低溫度,說明T2溫度低,
故答案為:>;
(2)達到平衡后,保持溫度和體積不變,向甲容器內再充入0.8molH2O和3.2molH2,氫氣和水的濃度之比等于達到平衡時二者的濃度之比,根據平衡常數表達式的特點,則此時Qc=K,所以正逆反應速率相等,故答案為:=;
(3)A.2V逆(CO2)═V正(H2)才能證明正逆反應速率相等,故A錯誤;
B.混合氣體的密度等于質量和體積的比值,質量變化,體積不變,所以密度保持不變能證明達到了平衡,故B正確;
C.c(H2O):c(CO2):c(H2)=2:1:2不能說明正逆反應速率相等,故C錯誤;
D.混合氣體的平均相對分子質量等于氣體質量和物質的量的比值,二者的比值是一個變量,所以混合氣體的平均相對分子質量保持不變證明達到了平衡,故D正確;
故選BD;
(4)t1到t6平衡都逆向移動,而t6時平衡正向移動,是因為增加反應物的濃度,而C是固體,所以是增加水蒸氣的量,所以本身的轉化率降低,t8時反應速率增大,但平衡不移動,故平衡轉化率最低t7-t8 (或“t7到t8”),t6時刻速率逆反應速率在原來基礎上增大,平衡逆向移動,所以是通入H2O,故答案為:通入H2O;t7-t8.
點評 本題考查了化學平衡狀態的判斷、平衡移動原理的應用等知識,掌握基礎是關鍵,難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化合物 | 甲 | 乙 | 丙 |
| 組成元素 | B、C | A、C | C、D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
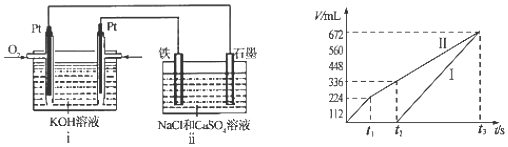
 如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 目前工業上主要采用接觸法制硫酸,并使用熱交換器充分利用反應中放出的熱量 | |
| B. | 從海水中提取溴,是將提取粗鹽后的母液濃縮、氧化,使溶液中的溴離子發生氧化反應轉化成溴單質,就得到粗溴 | |
| C. | 工業上合成氨沒有采用更大的壓強是從設備和動力要求方面考慮的 | |
| D. | 離子交換膜在工業生產中廣泛應用,如氯堿工業使用了陽離子交換膜 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗操作 | 預期現象及結論 |
| 步驟1:取少量樣品b于燒杯中,加足量蒸餾水,并用玻璃棒攪拌 | 樣品溶解,形成無色溶液. |
| 步驟2:取少量步驟1形成的溶液于試管中,再滴加少量NaOH溶液,振蕩 | 有白色沉淀生成,說明樣品b中添加了鎂鹽 |
| 步驟3:取少量步驟1形成的溶液于試管中,再滴加少量的BaCl2溶液振蕩 | 若有白色沉淀產生,則添加的是MgSO4.若無明顯現象,則添加的是MgCl2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com