
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ②③ |
分析 化學反應的原則是:酸性強的酸制弱酸弱的酸,一般情況不能由弱酸制強酸.碳酸的酸性強于硅酸、次氯酸,弱于鹽酸.
解答 解:①CaCl2溶液與二氧化碳不反應,故①不會產生沉淀;②NaAlO2溶液通入過量的二氧化碳,由于碳酸酸性比氫氧化鋁強,所以生成氫氧化鋁白色沉淀和碳酸氫鈉,2H2O+NaAlO2+CO2=Al(OH)3↓+NaHCO3,故②產生白色沉淀;③Ca(OH)2通入過量的二氧化碳,2CO2+Ca(OH)2=Ca(HCO3)2,不會產生沉淀,故③不會產生沉淀;④飽和Na2CO3溶液通入足量的二氧化碳,由Na2CO3+H2O+CO2=2NaHCO3可知,此反應消耗水,且Na2CO3轉化為NaHCO3后溶質質量增加,又因NaHCO3溶解度較小,所以會有晶體析出,故④會產生沉淀,
故選B.
點評 本題考查了碳的氧化物及其對應碳酸鹽和碳酸氫鹽的性質,題目難度不大,注意碳酸鈉和碳酸氫鈉溶解性的差別.


 優百分課時互動系列答案
優百分課時互動系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸與Na2SiO3溶液混合:SiO32-+2H+═H2SiO3 | |
| B. | Cl2和H2O反應:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NO2通入水中:H2O+3NO2═2H++2NO3-+NO | |
| D. | 濃鹽酸和二氧化錳共熱制Cl2:MnO2+4H++2Cl-═Mn2++Cl2+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 物質 | 雜質 | 除雜試劑 | 操作方法 |
| A | CaCl2溶液 | 稀鹽酸 | 過量碳酸鈣 | 過濾 |
| B | NaCl溶液 | NaBr | 稍過量氯水、乙醇 | 萃取、分液 |
| C | NaCl溶液 | Na2CO3 | 適量硝酸鈣溶液 | 過濾 |
| D | O2 | CO | 氧化銅 | 通過灼熱的氧化銅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定濃度的氨水加水稀釋的過程中,c(NH4+)/c(NH3•H2O)的比值減小 | |
| B. | 濃度均為0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1與pH=2的CH3COOH)溶液中,c(H+)濃度之比為1:10 | |
| D. | 常溫下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,則Ag2CrO4懸濁液中的c(Ag+)一定小于AgCl懸濁液中的c(Ag+) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Li2NH中N的化合價是-1 | B. | 該反應中H2既是氧化劑又是還原劑 | ||
| C. | H-的離子半徑比Li+大 | D. | 此法儲氫和鋼瓶儲氫的原理相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
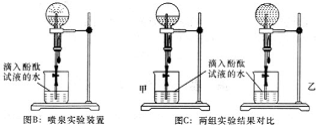
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | CH4(g)+2O2(g)→CO2(g)+2H2O(g)+Q1 CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)+Q2 | |
| B. | S(s)+O2(g)→SO2(g)+Q1 S(g)+O2(g)→SO2(g)+Q2 | |
| C. | H2(g)+Br2(g)→2HBr(q)+Q1 H2(g)+Cl2(g)→2HCl(q)+Q2 | |
| D. | HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)+Q1 CH3COOH(aq)+NaOH(aq)→CH3COONa(aq)+H2O(l)+Q2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應放出大量的熱,甲烷可用作氣體燃料 | |
| B. | 如溫度超過100℃,反應前后氣體的體積不變 | |
| C. | 可用干燥的冷燒杯檢驗生成的產物為CO2和H2O | |
| D. | 此式中使用箭頭表示此反應主產物為CO2和H2O,還可能有其他副產物如CO、C等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com