
| A. | 上述兩個反應都是置換反應 | |
| B. | 反應①中若有1mol Br2生成,則轉移電子的物質的量為2mol | |
| C. | 氧化性由強到弱順序為:KClO3>Cl2>Br2 | |
| D. | 反應②中還原劑與氧化劑的物質的量之比為6:1 |
分析 A.置換反應中不僅有單質生成還必須有單質參加;
B.生成1mol溴需要得到2mol電子;
C.根據同一化學反應中,氧化劑的氧化性大于氧化產物的氧化性來判斷氧化性強弱;
D.先確定還原劑和氧化劑,再根據它們計量數之間的關系式判斷.
解答 解:A.①為置換反應,②中生成物有單質但反應物沒有單質,所以不是置換反應,故A錯誤;
B.反應①中溴離子從-1價變為0價,若有1mol Br2生成,則轉移的電子的物質的量為:1mol×2×[0-(-1)]=2mol,故B正確;
C.Cl2+2KBr=2KCl+Br2中氧化劑是氯氣,氧化產物是溴,所以氯氣的氧化性大于溴,②KClO3+6HCl=3Cl2+KCl+3H2O中氧化劑是氯酸鉀,氧化產物是氯氣,氯酸鉀的氧化性大于氯氣,則氧化性強弱順序是 KClO3>Cl2>Br2,故C正確;
D.②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化劑是氯酸鉀,參加反應的$\frac{5}{6}$的氯化氫作還原劑,所以還原劑和氧化劑的物質的量之比是5:1,故D錯誤;
故選BC.
點評 本題考查了氧化還原反應,題目難度中等,明確元素化合價變化是解本題的關鍵,易錯選項是D,注意該選項中不是所有氯化氫都參加氧化還原反應,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2L四氯化碳所含分子的數目為0.5NA | |
| B. | 87g MnO2與4mol濃鹽酸共熱完全反應,能得到Cl2分子的數目為NA | |
| C. | 1mol Na2O2與足量CO2或水反應時,轉移電子的數目為NA | |
| D. | 1mol/L的NaOH溶液中含Na+數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4.816g | B. | 0.78g | C. | 4.66g | D. | 5.44g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學事實 | 主要影響因素 | |
| (1) | 集氣瓶中有H2和Cl2的混合氣體,在瓶外點燃鎂條時發生爆炸 | |
| (2) | 黃鐵礦煅燒前,要先粉碎成細小的礦粒 | |
| (3) | 實驗室用濃鹽酸而不用稀鹽酸與MnO2反應制備氯氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
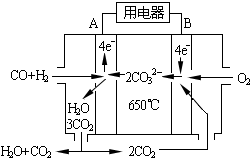 (6)工業上可回收CO作燃料.如圖是MCFC燃料電池,它是以水煤氣(CO、H2)為燃料,一定比例Li2CO3和Na2CO3低熔混合物為電解質.A為電池的負(填“正”或“負”)極,寫出B極電極反應式:2CO2+O2+4e-=2CO32-.
(6)工業上可回收CO作燃料.如圖是MCFC燃料電池,它是以水煤氣(CO、H2)為燃料,一定比例Li2CO3和Na2CO3低熔混合物為電解質.A為電池的負(填“正”或“負”)極,寫出B極電極反應式:2CO2+O2+4e-=2CO32-.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molH2和1mol I2完全反應放出4.5kJ熱量 | |
| B. | 1個氫分子和1個碘分子完全反應放出9kJ熱量 | |
| C. | 1molH2和1mol I2完全反應生成氣態HI放出9kJ熱量 | |
| D. | 0.5mol H2和0.5mol I2完全反應需要吸收4.5kJ熱量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com