
NA表示阿伏伽德羅常數,下列敘述正確的是
A.標況下,22.4LSO3含有σ鍵數目為3NA
B.已知:N2(g)+3H2(g) 2NH3(g) ΔH= —92kJ·mol-1,則某容器內加入0.5 NA個N2(g)與足量的H2 (g),充分反應后放出的熱量為46 kJ
2NH3(g) ΔH= —92kJ·mol-1,則某容器內加入0.5 NA個N2(g)與足量的H2 (g),充分反應后放出的熱量為46 kJ
C.標準狀況下,22.4L氦氣含有的原子數為2NA[
D.0.1mol H CN分子中含有的π鍵數目為0.2NA
CN分子中含有的π鍵數目為0.2NA
 輕松課堂單元測試AB卷系列答案
輕松課堂單元測試AB卷系列答案 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源:2015-2016學年福建省高一下期末化學試卷(解析版) 題型:選擇題
己知葡萄糖的結構簡式為CH2OH(CHOH)4CHO,由此判斷下列關于葡萄糖性質的敘述中不正確的是
A.葡萄糖能發生酯化反應
B.葡萄糖具有還原性
C.葡萄糖充分燃燒的產物為CO2與H2O
D.完全燃燒等質量的葡萄糖和甲醛,所需氧氣物質的量不相同
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高一創新班下期末化學試卷(解析版) 題型:填空題
(1)某溫度(t℃)時,測得0.01mol/L的NaOH溶液的pH=11,則該溫度下水的KW=_______。在此溫度下,將pH=a的NaOH溶液Va L與pH=b的H2SO4溶液Vb L混合,若所得混合液為中性,且a+b=12,則Va:Vb=___________。
(2)25℃時,0.1mol/L的HaA溶液中c(H+)/c(OH-)=1010,請回答下列問題:
①HaA是___________(填“強電解質”或“弱電解質”)。
②在加水稀釋HaA溶液的過程中,隨著水量的增加而增大的是__________(填字母)
A.c(HaA) B.c(H+)/c(HaA) C.c(H+)與c(OH-)的乘積 D.c(OH-)
③NanA溶液顯__________(填“酸性”、“中性”或“堿性”),理由是(用離子方程式表示)____________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都外國語學校高一下期末理科化學卷(解析版) 題型:填空題
回答下列問題:
(1)已知下列反應:SO2 (g)+2OH? (aq) ===SO32? (aq)+H2O(l) ΔH1
(g)+2OH? (aq) ===SO32? (aq)+H2O(l) ΔH1
ClO? (aq)+SO32? (aq) ==SO42? (aq)+Cl? (aq) ΔH2 CaSO4(s ) ==Ca2+(aq)+SO42?(aq) ΔH3
) ==Ca2+(aq)+SO42?(aq) ΔH3
則反應SO2(g)+ Ca2+(aq)+ ClO? (aq) +2OH? (aq) === CaSO4(s) +H2O(l) +Cl? (aq)的ΔH=______。(用ΔH1 ΔH2ΔH3表示)
(2)工業上用H2和Cl2反應制HCl,各鍵能數據為:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.該反應的熱化學方程式是 。
(3)合成氣(CO和H2為主的混合氣體)不但是重要的燃料也是重要的化工原料,制備合成氣的方法有多種,用甲烷制備合成氣的反應為:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
氫氣與氧氣反應生成水蒸氣的熱化學方程式為 。
現 有1mol由H2O(g)與O2組成的混合氣,且O2的體積分數為x,將此混合氣與
有1mol由H2O(g)與O2組成的混合氣,且O2的體積分數為x,將此混合氣與 足量CH4充分反應.若x=0.2時,反應①放出的能量為 kJ;若x= 時,反應①與②放出(或吸收)的總能量為0。
足量CH4充分反應.若x=0.2時,反應①放出的能量為 kJ;若x= 時,反應①與②放出(或吸收)的總能量為0。
(4) 一定條件,在水溶液中1  mol Cl-和1 mol ClOx-(x=1,2,3,4)的能量(KJ)相對大小如圖所示
mol Cl-和1 mol ClOx-(x=1,2,3,4)的能量(KJ)相對大小如圖所示
。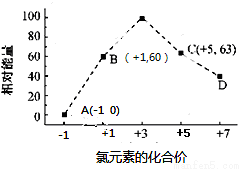
①D是 (填離子符號)。
②B→A+C反應的熱化學方程式為 (用離子符號表示)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都外國語學校高一下期末理科化學卷(解析版) 題型:選擇題
將1L 0.1 mol/L BaCl2溶液與足量稀硫酸充分反應放出a kJ熱量;將1L 0.5 mol/L HCl溶液與足量CH3COONa溶液充分反應放出b kJ熱量(不考慮醋酸鈉水解);將0.5L 1 mol/L H2SO4溶液與足量(CH3COO)2Ba(可溶性強電解質)溶液反應放出的熱量為
A.(5a+2b) kJ B.(4b-10a) kJ
C.(5a-2b) kJ D.(10a+4b) kJ
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都外國語學校高一下期末理科化學卷(解析版) 題型:選擇題
圖甲和圖乙表示的是短周期部分或全部元素的某種性質的遞變規律,下列說法正確的是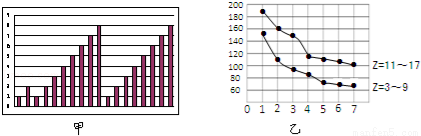
A. 圖甲橫坐標為原子序數,縱坐標表示元素的最高正價
B. 圖甲橫坐標為核電荷數,縱坐標表示元素的原子半徑(單位:pm)
C. 圖乙橫坐標為最高正價,縱坐標表示元素的原子半徑(單位:pm)
D. 圖乙橫坐標為最外層電子數,縱坐標表示元素的原子半徑(單位:pm)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都外國語學校高一下期末理科化學卷(解析版) 題型:選擇題
下列有關物質性質的比較正確的是
①同主族元素的單質從上到下,氧化性逐漸減弱,熔點逐漸升高
②元素的非金屬性越強,氣態氫化物的熱穩定性越弱
③單質與水反應的劇烈程度:F2>Cl2>Br2>I2
④元素的非金屬性越強,它的氣態氫化物水溶液的酸性越強
⑤還原性:S2﹣>Se2﹣
⑥酸性:HNO3>H3PO4.
⑦原子半徑:K>Cl>S>O>F
A. ①③ B. ②④⑦ C. ③⑥ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化學 來源:2015-2016學年浙江省高一下期末化學試卷(解析版) 題型:選擇題
A、B、C、D、E均為短周期主族元素,B、C、D在周期表中的位置關系如下圖所示。A是短周期中原子半徑最小的元素,A、B、C三種元素的原子序數之和等于D元素的原子序數,E是短周期中最活潑的金屬元素。下列說法錯誤的是
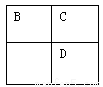
A. 簡單離子的半徑大小關系:B>C>E
B. C元素的氣態氫化物比D元素的氣態氫化物穩定是氫鍵的緣故
C. 由A、B兩種元素組成的離子化合物NH5中,陰、陽離子個數比為1:1
D. 由C、D、E三種元素組成的某種化合物,其水溶液能與鹽酸反應產生沉淀
查看答案和解析>>
科目:高中化學 來源:2015-2016學年浙江省高二下期末化學試卷(解析版) 題型:簡答題
【加試題】污染物的有效去除和資源的充分利用是化學造福人類的重要研究課題。某研究小組利用軟錳礦(主要成分為MnO2,另含少量鐵,鋁,銅,鎳等金屬化合物)作脫硫劑,通過如下簡化流程,既脫除燃煤尾氣中的SO2,又制得電池材料MnO2(反應條件已省略)。
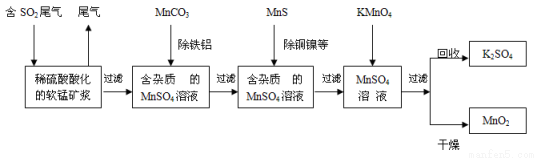
請回答下列問題:
(1)上述流程脫硫實現了 (選填下列字母編號)。
A.廢棄物的綜合利用 B.白色污染的減少 C.酸雨的減少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(3)已知:25℃、101kPa時,
Mn(s)+O2(g)=MnO2(s) ??ΔH = -520kJ/mol
S(s)+O2(g)=SO2(g) ?ΔH = -297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ?ΔH = -1065kJ/mol
SO2與MnO2反應生成無水MnSO4的熱化學方程式是 。
(4)MnO2可作超級電容材料。用惰性電極電解MnSO4溶液可制得MnO2,其陽極的電極反應式是 。
(5)假設脫除的SO2只與軟錳礦漿中MnO2反應。按照圖示流程,將5 m3(標準狀況)含SO2的體積分數為3 %的尾氣通入礦漿,若SO2的脫除率為89.6%,最終每得到MnO2的質量1 kg,則除去鐵、鋁、銅、鎳等雜質時,所引入的錳元素相當于MnO2 kg。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com