
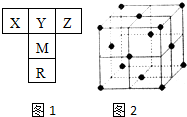
 如圖1是元素周期表的一部分.已知R的核電荷數小于36,氣態氫化物沸點:MHn>YHn.
如圖1是元素周期表的一部分.已知R的核電荷數小于36,氣態氫化物沸點:MHn>YHn.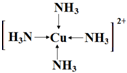
分析 R的核電荷數小于36,由元素在周期表中相對位置,可知X、Y、Z處于第二周期,M處于第三周期,R處于第四周期,氣態氫化物沸點:MHn>YHn,氫化物YHn分子之間沒有氫鍵,H元素與Al元素之間不能形成氣態氫化物,則Y為C元素、M為Si、R為Ge、X為B、Z為N元素.
解答 解:R的核電荷數小于36,由元素在周期表中相對位置,可知X、Y、Z處于第二周期,M處于第三周期,R處于第四周期,氣態氫化物沸點:MHn>YHn,氫化物YHn分子之間沒有氫鍵,H元素與Al元素之間不能形成氣態氫化物,則Y為C元素、M為Si、R為Ge、X為B、Z為N元素.
(1)同主族自上而下第一電離能減小,同周期隨原子序數增大,元素第一電離能增大,氮元素2p能級為半滿穩定狀態,第一電離能高于同周期相鄰元素的,表中五種元素第一電離能最大的是N元素,Y的最簡單氫化物為CH4,分子的空間構型為正四面體.基態R原子外圍電子排布式為4s24p2有 2個未成對電子,
故答案為:N;正四面體;2;
(2)Y的最高價氧化物為分子晶體,M的最高價氧化物為原子晶體,故Y的最高價氧化物熔點比M的最高價氧化物熔點低,CN-與氮氣分子互為等電子體,CN-中C原子與N原子之間形成3對共用電子對,則σ鍵與π鍵的數目比為1:2,
故答案為:Y的最高價氧化物是分子晶體,M的最高價氧化物是原子晶體;1:2;
(3)CO32-中C原子孤電子對數=$\frac{4+2-2×3}{2}$=0,價層電子對數=3+0=3,C原子的雜化方式是sp2,一種與CO32-互為等電子體的粒子為:NO3-,
故答案為:sp2;NO3-;
(4)Z的一種常見氫化物能與硫酸銅反應生成配合物,該配合物中的陽離子: ,
,
故答案為: ;
;
(5)以頂點原子研究,與之相鄰的原子處于面心,每個頂點為8個晶胞共用,每個面心為2個晶胞共用,
該晶體中配位數是$\frac{3×8}{2}$=12,晶胞中原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,設金屬的相對原子質量為M,則4×$\frac{M}{6.02×1{0}^{23}}$g=2.7g/cm3×(0.405×10-7cm)3,解得M=27,
故答案為:12;27.
點評 本題是對物質結構與性質的考查,涉及元素周期表、電離能、核外電子排布、分子構型與雜化方式、晶體類型與性質、配合物、晶胞計算等,熟練掌握元素周期表結構,注意氫鍵對物質性質的影響.


科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 實驗現象 | 實驗結論 | |
| 步驟① | 取適量NaOH固體放入燒杯中,加入適量的水,攪拌,插入一支溫度計 測量溶液溫度, | 溶液溫度比室 溫明顯升高 | 氫氧化鈉 固體溶于 水放熱 |
| 步驟② | 步驟①所得的溶 液冷卻到室溫,用膠頭滴管將稀鹽酸滴入到步驟①所得的溶液中 | 溶液溫度比室 溫明顯升高 | 氫氧化鈉與稀鹽 酸反應會放出熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
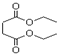
| A. | 1mol琥珀酸二乙酯能與4mol的NaOH反應 | |
| B. | 琥珀酸二乙酯在一定條件下能發生取代、加成和氧化反應 | |
| C. | 琥珀酸的分子式為C4H8O4 | |
| D. | 琥珀酸分子中含有六元環 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
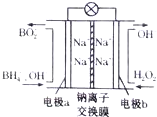 據報道,以硼氫化合物NaBH4(B元素的化合價為+3價)和H2O2作原料的燃料電池,其負極材料采用Pt/C,正極材料采用MnO2,可用作空軍通信衛星電源,其工作原理如圖所示.下列說法正確的是( )
據報道,以硼氫化合物NaBH4(B元素的化合價為+3價)和H2O2作原料的燃料電池,其負極材料采用Pt/C,正極材料采用MnO2,可用作空軍通信衛星電源,其工作原理如圖所示.下列說法正確的是( )| A. | 該電池的負極反應為BH4-+8OH--8e-═BO2-+6H2O | |
| B. | 電池放電時Na+從b極區移向a極區 | |
| C. | 每消耗3mol H2O2,轉移的電子為3mol | |
| D. | 電極a采用Mn02作電極材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 78 g Na2O2中存在的共價鍵總數為NA | |
| B. | 0.1 mol${\;}_{38}^{90}$Sr原子中含中子數為3.8NA | |
| C. | 氫氧燃料電池負極消耗2.24 L氣體時,電路中轉移的電子數為0.1NA | |
| D. | 0.1 mol氯化鐵溶于1L水中,所得溶液中Fe3+的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
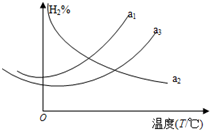 利用合成氣(主要成分為CO、CO2和H2)合成甲醇,發生的主要反應如下:
利用合成氣(主要成分為CO、CO2和H2)合成甲醇,發生的主要反應如下:| 反應時間t/min | 20 | 40 | 60 | 80 |
| c(CO2)(mol/L) | 0.300 | 0.180 | 0.109 | 0.066 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
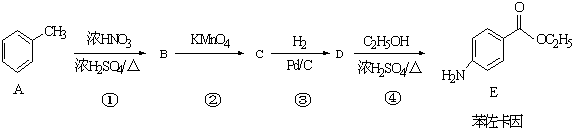
 .
.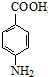 +CH3CH2OH$→_{△}^{濃硫酸}$
+CH3CH2OH$→_{△}^{濃硫酸}$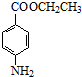 +H2O
+H2O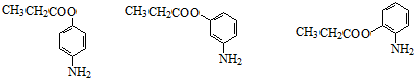 (其中一種)(任寫一種)
(其中一種)(任寫一種) )的合成路線圖(其他原料任選).
)的合成路線圖(其他原料任選).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com