
| A. | 溶液的pH | B. | 醋酸的電離常數 | ||
| C. | 中和時所需NaOH的量 | D. | 溶液中的c(CH3COOH) |
分析 醋酸為弱電解質,醋酸的濃度越大,則電離程度越小,但是溶液中氫離子濃度越大;中和時消耗的強氧化鈉的物質的量取決于醋酸的物質的量,據此進行判斷.
解答 解:A.酸的濃度越大,c(H+)越大,pH越小,前者氫離子濃度小,所以pH前者大于后者,故A正確;
B.醋酸的電離常數只與溫度有關,溫度相同,電離常數相同,故B錯誤;
C.計算兩溶液中醋酸的物質的量,n(前)=c1•V1=0.1 L×0.01 mol•L-1=1×10-3 mol,n(后)=c2•V2=0.01 L×0.1 mol•L-1=1×10-3 mol,兩者相等,因而中和時消耗的NaOH的量相等,故C錯誤;
D.由n=cV可知,100mL 0.01mol/L的醋酸溶液中溶質的物質的量為0.001mol,10mL0.1mol/L的醋酸溶液中溶質的物質的量為0.001mol,但前者濃度小,電離程度大,前者的CH3COOH的物質的量小,故D錯誤;
故選A.
點評 本題考查弱電解質的電離平衡及其影響,題目難度不大,注意把握弱電解質的電離特點,明確醋酸濃度越大、電離程度越小是解題的關鍵.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年陜西省高一上第一次月考化學卷(解析版) 題型:計算題
把5.3%的Na2CO3溶液蒸發掉60g水后,溶液變為20mL,濃度變為15.9%,則濃縮后Na2CO3溶液的物質的量濃度為多少?
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在CH3COONa溶液中通入SO2,生成CH3COOH | |
| B. | 等濃度的鹽酸、CH3COOH溶液分別和鋅反應,開始時鹽酸的反應速率快 | |
| C. | 常溫下0.1 mol•L-1 CH3COOH溶液的pH=2.1 | |
| D. | 用CH3COOH溶液做導電實驗,燈泡很暗 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
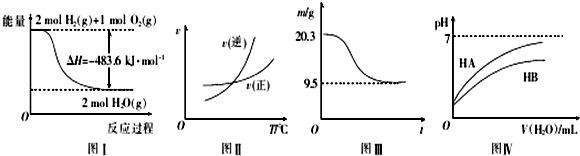
| A. | 圖I表示H2與O2發生反應過程中的能量變化,則H2的燃燒熱△H=-241.8 kJ.mol-1 | |
| B. | 圖Ⅱ表示某可逆反應正、逆反應速率隨溫度的變化,則該反應的正反應是放熱反應 | |
| C. | 圖Ⅲ表示0.1 mol MgCl2•6H2O在空氣中充分加熱時固體質量隨時間的變化 | |
| D. | 圖Ⅳ表示常溫下,稀釋HA、HB兩種酸的稀溶液時,溶液pH隨加水量的變化,則NaA溶液的pH大于同濃度NaB溶液的pH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學生用已知物質的量濃度的鹽酸來滴定未知物質的量濃度的氫氧化鈉溶液時,選擇酚酞作指示劑.請填寫下列空白:
某學生用已知物質的量濃度的鹽酸來滴定未知物質的量濃度的氫氧化鈉溶液時,選擇酚酞作指示劑.請填寫下列空白:| 滴定次數 | 待測氫氧化鈉溶液的體積/mL | 0.1000mol/L鹽酸的體積(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室中有一瓶含有一定量雜質的燒堿樣品,某學生用中和滴定法測定燒堿的純度,若燒堿中含有與酸不反應的雜質,請根據實驗回答:
實驗室中有一瓶含有一定量雜質的燒堿樣品,某學生用中和滴定法測定燒堿的純度,若燒堿中含有與酸不反應的雜質,請根據實驗回答:| 滴定次數 | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com