
下列說法不正確的是
A.稀醋酸中加入少量醋酸鈉固體減小醋酸的電離程度
B.0.02 mol·L-1HCl溶液與0.02 mol·L-1Ba(OH)2溶液等體積混合后,溶液pH約為12
C.兩種醋酸溶液的物質的量濃度分別為c1和c2,pH分別為a和a+1,則c1=10c2
D.pH=11的NaOH溶液與pH=3的醋酸溶液等體積混合,滴入石蕊溶液呈紅色
【答案】C
【解析】
試題分析:A.醋酸在溶液中存在電離平衡:CH3COOH CH3COO-+H+,當想稀醋酸中加入少量醋酸鈉固體時,溶液中c(CH3COO-)增大,醋酸的電離平衡逆向移動,從而減小了醋酸的電離程度,正確;B.0.02 mol·L-1HCl溶液與0.02 mol·L-1Ba(OH)2溶液等體積混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室溫下水的離子積常數是10-14,所以c(H+)=10-12mol/L,故溶液pH約為12,正確;C.兩種醋酸溶液的物質的量濃度分別為c1和c2,pH分別為a和a+1,第一種溶液中氫離子的濃度是第二種溶液中氫離子濃度的10倍。由于溶液的濃度越大,其電離程度就越小,所以則c1>10c2,錯誤;D.pH=11的NaOH溶液的氫氧根離子的濃度與pH=3的醋酸溶液中氫離子的濃度相等。由于醋酸是弱酸,主要以電解質分子存在,在溶液中存在電離平衡,黨二者等體積混合后,由于醋酸過量,溶液顯酸性,滴入石蕊溶液時,溶液呈紅色,正確。
CH3COO-+H+,當想稀醋酸中加入少量醋酸鈉固體時,溶液中c(CH3COO-)增大,醋酸的電離平衡逆向移動,從而減小了醋酸的電離程度,正確;B.0.02 mol·L-1HCl溶液與0.02 mol·L-1Ba(OH)2溶液等體積混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室溫下水的離子積常數是10-14,所以c(H+)=10-12mol/L,故溶液pH約為12,正確;C.兩種醋酸溶液的物質的量濃度分別為c1和c2,pH分別為a和a+1,第一種溶液中氫離子的濃度是第二種溶液中氫離子濃度的10倍。由于溶液的濃度越大,其電離程度就越小,所以則c1>10c2,錯誤;D.pH=11的NaOH溶液的氫氧根離子的濃度與pH=3的醋酸溶液中氫離子的濃度相等。由于醋酸是弱酸,主要以電解質分子存在,在溶液中存在電離平衡,黨二者等體積混合后,由于醋酸過量,溶液顯酸性,滴入石蕊溶液時,溶液呈紅色,正確。
考點:考查電解質溶液的有關知識。
【題型】選擇題
【適用】較難
【標題】【百強校】2015-2016學年陜西西安高新一中高一下期末化學試卷(帶解析)
【關鍵字標簽】
【結束】
一定量的混合氣體,在密閉容器中發生如下反應:xA(g)+yB(s) zC(g),達到平衡后測得A氣體的濃度為0.5 mol·L-1,當恒溫下將密閉容器的容積擴大到兩倍再達到平衡后,測得A的濃度為0.3 mol·L-1,則下列敘述正確的是
zC(g),達到平衡后測得A氣體的濃度為0.5 mol·L-1,當恒溫下將密閉容器的容積擴大到兩倍再達到平衡后,測得A的濃度為0.3 mol·L-1,則下列敘述正確的是
A.C的體積分數降低
B.x+y=z
C.平衡向正反應方向移動
D.x+y<z
 一課一練課時達標系列答案
一課一練課時達標系列答案科目:高中化學 來源:2015-2016學年江西省高二下學期期末考試化學試卷(解析版) 題型:選擇題
已知鏈式炔碳C300經過適當處理可得含多個—C≡C—(不含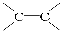 )的鏈狀化合物C300H298,則該分子中含—C≡C—的個數為( )
)的鏈狀化合物C300H298,則該分子中含—C≡C—的個數為( )
A.70 B.72 C.74 D.76
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省懷化市高一下學期期末考試化學試卷(解析版) 題型:選擇題
下列措施不利于改善湖南地區環境質量的是
A.回收廢電池
B.使用太陽能熱水器
C.使用不易降解的塑料餐具
D.推廣使用清潔燃料的公交車
查看答案和解析>>
科目:高中化學 來源:2015-2016學年重慶一中高一下期末化學試卷(解析版) 題型:選擇題
下列變化過程中,只破壞共價鍵的是
A.I2 升華
B.NaCl顆粒被粉碎
C.HCl溶于水得鹽酸
D.從NH4HCO3中聞到了刺激性氣味
查看答案和解析>>
科目:高中化學 來源:2015-2016學年陜西西安高新一中高一下期末化學試卷(解析版) 題型:填空題
X、Y、Z、J、Q五種短周期主族元素,原子序數依次增大,元素Z在地殼中含量最高,J元素的焰色反應呈黃色,Q的最外層電子數與其電子總數比為3:8,X能與J形成離子化合物,且J+的半徑大于X-的半徑,Y2是空氣的主要成分之一。請回答:
(1)Q元素在周期表中的位置_______________________;
(2)這五種元素原子半徑從大到小的順序為_____________________________(填元素符號)。
(3)元素的非金屬性Z____Q(填“>”或“<”),下列各項中,不能說明這一結論的事實有 (填序號)
A.Q的氫化物的水溶液放置在空氣中會變渾濁 |
B.Z與Q之間形成的化合物中元素的化合價 |
C.Z和Q的單質的狀態 |
D.Z和Q在周期表中的位置 |
(4)X與Y可形成簡單分子A,寫出A的電子式_______________;實驗室制備氣體A的化學方程式 。
【答案】(1)第三周期第VIA族 (2)Na>S>N>O>H
(3)> ;C;(4) 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
【解析】試題分析:X、Y、Z、J、Q五種短周期主族元素,原子序數依次增大,元素Z在地殼中含量最高,則Z為O元素;J元素的焰色反應呈黃色,則J為Na;Q的最外層電子數與其電子總數比為3:8,原子序數大于Na元素,故Z處于第三周期,則Q為S元素;X能與J形成離子化合物,且J+的半徑大于X-的半徑,可推知X為H元素;Y的氧化物是形成酸雨的主要物質之一,結合(5)中X與Y可形成分子,也可形成陽離子,則Y為N元素。(1)Q為S元素,原子核外有3個電子層、最外層電子數為6,處于周期表中第三周期ⅥA族;(2)同周期自左而右原子半徑減小,電子層越多原子半徑越大,故原子半徑:Na>S>N>O>H;(3)O、S同主族自上而下非金屬性減弱,故非金屬性O>S;a.H2S的水溶液放置在空氣中會變渾濁,說明氧氣能氧化硫化氫生成硫,則氧氣的氧化性大于S,說明O元素非金屬較強,正確;b.S與O元素形成的化合物中S元素表現正化合價,O元素表現負化合價,氧原子對鍵合電子吸引力更大,氧元素非極性較強,正確;c.單質狀態屬于物理性質,不能比較非金屬性強弱,錯誤;d.同主族自上而下非金屬性減弱,故非金屬性O>S,正確,(4)X與Y可形成分子A,也可形成陽離子B,A、B在水溶液中酸、堿性恰好相反,A為NH3,電子式為 ,在實驗室是用NH4Cl和Ca(OH)2混合加熱制取氨氣,反應的化學方程式是:2NH4Cl+Ca(OH)2
,在實驗室是用NH4Cl和Ca(OH)2混合加熱制取氨氣,反應的化學方程式是:2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
考點:考查元素化合物推斷、物質結構與性質機元素在周期表的位置關系應用的知識。
【題型】推斷題
【適用】較難
【標題】【百強校】2015-2016學年陜西西安高新一中高一下期末化學試卷(帶解析)
【關鍵字標簽】
【結束】
在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)  CO(g)+H2O(g),其化學平衡常數K與溫度t的關系如下表:
CO(g)+H2O(g),其化學平衡常數K與溫度t的關系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
請回答下列問題:
(1)該反應的化學平衡常數表達式K= 。
(2)該反應為 反應(填“吸熱”或“放熱”)。
(3)830℃,在1L的固定容器的密閉容器中放入1 mol CO和5 mol H2O,反應達平衡后,其化學平衡常數K 1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反應達到平衡。在其他條件不變的情況下,擴大容器的體積,平衡 移動。(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃時,在某時刻該容器中CO2、H2、CO、H2O的濃度分別為2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,則此時上述反應的平衡移動方向為 (選填“正反應方向”、“逆反應方向”、“不移動”)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年陜西西安高新一中高一下期末化學試卷(解析版) 題型:選擇題
下列裝置或操作能達到實驗目的的是
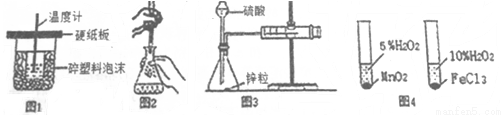
A.圖1裝置用于中和熱的測定
B.圖2裝置用于高錳酸鉀溶液滴定草酸
C.圖3裝置用于測定氫氣的反應速率(單位mL/s)
D.圖4裝置用于研究不同催化劑對反應速率的影響
查看答案和解析>>
科目:高中化學 來源:2015-2016學年陜西西安高新一中高一下期末化學試卷(解析版) 題型:選擇題
下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同質子數和電子數的一組是
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省高一下期末化學試卷(解析版) 題型:選擇題
為提純下列物質(括號內的物質為雜質),所選用的除雜試劑和分離方法都正確的是
A | B | C | D | |
被提純物質 | 酒精(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
除雜試劑 | 生石灰 | 氫氧化鈉溶液 | 酸性高錳酸鉀溶液 | KI溶液 |
分離方法 | 蒸餾 | 分液 | 洗氣 | 分液 |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年海南瓊海嘉積中學高一下期末文科化學試卷(解析版) 題型:選擇題
下列關于化學平衡的說法中,正確的是( )
A.當達到化學平衡時,各物質的濃度就不再變化了
B.當達到化學平衡時,反應物已完全轉化為生成物
C.當達到化學平衡時,反應混合物中各成分的濃度相等
D.當達到化學平衡時.正逆反應均已停止
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com