
分析 (1)根據蓋斯定律書寫熱化學方程式;
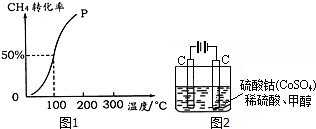
(2)100℃時達到平衡時,甲烷轉化率為50%,結合化學平衡三段式列式計算平衡時各組分的物質的量,
①根據c=$\frac{\frac{△n}{V}}{△t}$計算v(H2);
②計算平衡狀態時各物質的濃度,代入平衡常數表達式計算;
(3)其他條件不變,平衡后將容器的容積壓縮到原來的$\frac{1}{2}$,壓強增大,正、逆反應速率都增大,但正反應速率增大更多,平衡向正反應方向移動,生成物的濃度增大,由于溫度不變,則平衡常數不變,結合平衡常數可知,平衡時反應物各組分的濃度都增大,據此分析解答;
(4)①通電后,將Co2+氧化成Co3+,電解池中陽極失電子發生氧化反應,電極反應為Co2+-e-=Co3+;
②以Co3+做氧化劑把水中的甲醇氧化成CO2而凈化,自身被還原為Co2+,原子守恒與電荷守恒可知,還原生成H+;
③甲醇-空氣-KOH溶液的燃料電池,則電池負極上是燃料失電子的氧化反應,利用電池反應方程式2CH3OH+3O2+4KOH═2K2CO3+6H20分析.
解答 解:(1)I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依據蓋斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1
故答案為:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1;
(2)將1.0mol CH4和2.0mol H2O ( g )通入容積固定為100L的反應室,在一定條件下發生反應I,由圖象可知100℃甲烷轉化率為50%,故參加反應的甲烷為1mol×50%=0.5mol,則:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
變化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假設100℃時達到平衡所需的時間為5min,則用H2表示該反應的平均反應速率=$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,
故答案為:0.003 mol•L-1•min-1;
②100℃時反應I的平衡濃度為c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常數K=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案為:2.25×10-4;
(3)A.平衡后將容器的容積壓縮到原來的$\frac{1}{2}$,壓強增大,平衡向正反應方向移動,生成物的濃度增大,由于平衡常數不變,結合平衡常數可知,平衡時反應物各組分的濃度都增大,故A錯誤;
B.壓強增大,正、逆反應速率都增大,但正反應速率增大更多,故B錯誤;
C.壓強增大,平衡向正反應方向移動,CH3OH 的物質的量增加,故C正確;
D.壓強增大,平衡向正反應方向移動,氫氣的物質的量減小、甲醇的物質的量增大,故重新平衡$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$減小,故D正確;
E.平衡常數只受溫度影響,溫度不變,平衡常數不變,故E錯誤,
故答案為:CD;
(4)①通電后,將Co2+氧化成Co3+,電解池中陽極失電子發生氧化反應,電極反應為Co2+-e-=Co3+;
故答案為:Co2+-e-=Co3+;
②以Co3+做氧化劑把水中的甲醇氧化成CO2而凈化,自身被還原為Co2+,結合原子守恒與電荷守恒可知,還原生成H+,配平書寫離子方程式為:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案為:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③甲醇-空氣-KOH溶液的燃料電池,則電池負極上是燃料失電子的氧化反應CH3OH-6e-+8OH-=CO32-+6H2O,甲醇-空氣-KOH溶液的燃料電池的總反應方程式為:2CH3OH+3O2+4KOH═2K2CO3+6H2O,CH3OH與KOH的物質的量之比為1:2,1molCH3OH反應,應有2molKOH參與反應,
故答案為:CH3OH-6e-+8OH-=CO32-+6H2O;2.
點評 本題考查熱化學方程式書寫、化學平衡圖象、影響化學平衡因素、平衡常數與反應速率計算、原電池等,掌握基礎是解本題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
 硫酸鹽主要來自地層礦物質,多以硫酸鈣、硫酸鎂的形態存在,硫酸鹽有著許多重要的應用.
硫酸鹽主要來自地層礦物質,多以硫酸鈣、硫酸鎂的形態存在,硫酸鹽有著許多重要的應用.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1
(1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 以天然氣為原料合成甲醇常見的方法有水煤氣和目前正在開發的直接氧化法
以天然氣為原料合成甲醇常見的方法有水煤氣和目前正在開發的直接氧化法查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 石墨烯是從石墨中剝離出來的,其結構如圖所示.單層的石墨烯其厚度只有一個碳原子厚,被證實是世界上已經發現的最薄、最堅硬的物質,可制成電阻率最小的納米材料.下列關于石墨烯的說法正確的是( )
石墨烯是從石墨中剝離出來的,其結構如圖所示.單層的石墨烯其厚度只有一個碳原子厚,被證實是世界上已經發現的最薄、最堅硬的物質,可制成電阻率最小的納米材料.下列關于石墨烯的說法正確的是( )| A. | 石墨烯與金剛石互為同位素 | |
| B. | 從石墨中剝離得石墨烯需克服范德華力 | |
| C. | 石墨烯是高分子化合物 | |
| D. | 制成的納米材料微粒直徑在1nm~100nm,因此石墨烯納米材料屬于膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com