
二氯化砜(SO2Cl2)是一種重要的有機合成試劑,實驗室可利用SO2與Cl2反應制取少量的SO2Cl2,裝置如圖(有些支持裝置省略了)所示。
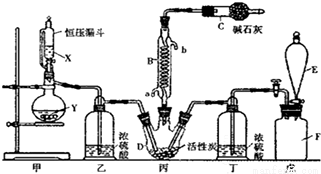
已知:SO2Cl2的熔點為-54.1℃,沸點為69.1℃,遇水能發生劇烈的水解反應,產物之一為氯化氫氣體。
(1)E中的試劑是飽和食鹽水,戊是貯氣裝置,則F瓶中氣體的實驗室制法是_______(用方程式表示);
(2)B處反應管冷卻水應從___________(填“a”或“b”)接口通入;
(3)裝置乙和丁的作用是___________;
(4)恒壓漏斗具有特殊的結構,主要目的是___________;
(5)寫出二氯化砜(SO2Cl2)水解反應的方程式___________;
(6)SO2溶于水生成亞硫酸,亞硫酸的酸性強于次氯酸,選用下面的裝置和藥品探究亞硫酸與次氯酸的酸性性強弱
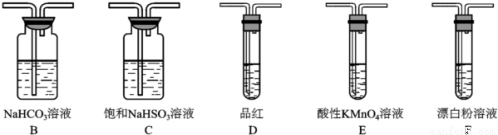
裝置連接順序為A、_____、_____、_____、D、F,其中裝置C的作用是_____,通過__________________________現象即可證明亞硫酸的酸性強于次氯酸。
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016屆江蘇省等三校高三第四次模擬化學試卷(解析版) 題型:填空題
有機物G是一種重要的有機合成中間體,可通過以下方法合成:
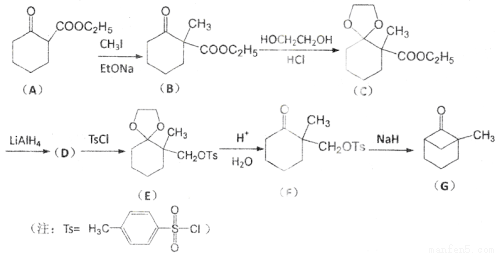
(1)寫出A中含氧官能團的名稱:____________和____________。
(2)寫出D的結構簡式:____________;
(3)將B轉化為化合物C的反應目的是____________;
(4)寫出一種符合下列條件的化合物C的同分異構體的結構簡式:____________;
①能發生水解反應
②能使溴的CC14溶液褪色
③分子中有2種不同化學環境的氫原子
(5)根據己有知識并結合相關信息寫出以丁烯酮(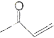 )、乙醛、乙二醇為主要原料制備5-羥基-2-己酮(
)、乙醛、乙二醇為主要原料制備5-羥基-2-己酮(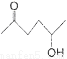 )的合成路線流程圖(有機溶劑乙醚和無機試劑任用)。合成路線流程圖示例如下:
)的合成路線流程圖(有機溶劑乙醚和無機試劑任用)。合成路線流程圖示例如下:
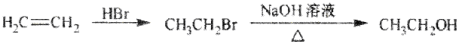
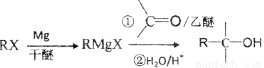
己知:鹵代烴可以和Mg生成格氏試劑(RMgX ),醛或酮可以和格氏試劑反應:
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三下學期猜題理綜化學試卷(解析版) 題型:推斷題
甲苯是一種重要的化工原料,可以參與合成很多物質。下圖為以甲苯為原料得到藥物苯佐卡因的合成路線。

已知:i.苯環上連有甲基時,再引入其他基團主要進入甲基的鄰位或對位;苯環上連有羧基時,再引入其他基團主要進入羧基的間位;
Ⅱ.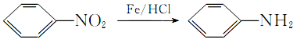 (有弱堿性,易被氧化)。
(有弱堿性,易被氧化)。
請回答下列問題:
(1)化合物C中官能團的結構簡式為____________,檢驗反應③進行程度的試劑有____________。
(2)合成路線中反應類型屬于取代反應的有____________個
(3)反應①的化學方程式為____________,該反應要控制好低溫條件,否則會生成一種新物質F,該物質是一種烈性炸藥,F的名稱為____________。
(4)反應⑤的化學方程式為____________。
(5)甲苯的鏈狀且僅含碳碳三鍵的同分異構體有____________種,其中滿足下列條件的同分異構體的結構簡式為____________。
①核磁共振氫譜只有兩個吸收峰②峰面積之比為1:3
(6)化合物 是一種藥物中間體,請寫出以甲苯為主要原料制備該中間體的合成路線流程圖:
是一種藥物中間體,請寫出以甲苯為主要原料制備該中間體的合成路線流程圖:
提示:①合成過程中無機試劑任選:②合成路線流程圖示例如下:

查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三高考打靶測試理綜化學試卷(解析版) 題型:填空題
磷元素的含氧酸有磷酸、亞磷酸、次磷酸等很多種,其中亞磷酸(H3PO3)是具有強還原性的二元弱酸,可以被銀離子氧化為磷酸。
(1)寫出亞磷酸與足量NaOH溶液反應的離子方程式____________________________;
(2)亞磷酸與銀離子反應時氧化劑與還原劑的物質的量之比為______________;
(3)某溫度下,0.10mol•L-1的H3PO3溶液的pH為1.6,即c(H+)=2.5×10-2mol•L-1,該溫度下H3PO3的電離平衡常數K=___________________;(H3PO3第二步電離忽略不計,結果保留兩們有效數字)
(4)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)
(5)電解Na2HPO3溶液也可得到亞磷酸,裝置示意圖如下:
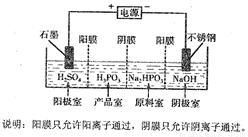
①產品室中反應的離子方程式為_______________________;
②得到1mol亞磷酸的同時,陰極室制得NaOH質量為________g。
(6)已知銨鹽的分解比較復雜,但分解時不涉及到化合價變化的銨鹽分解比較簡單,其實質就是質子的轉移(如NH4A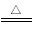 NH3+HA),磷酸對應的各種銨鹽分解時不涉及化合價變化,試從酸根離子結合氫離子難易的解度,判斷下列銨鹽的分解溫度:
NH3+HA),磷酸對應的各種銨鹽分解時不涉及化合價變化,試從酸根離子結合氫離子難易的解度,判斷下列銨鹽的分解溫度:
NH4H2PO4____________(NH4)2HPO4(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源:2016屆山東省高三高考打靶測試理綜化學試卷(解析版) 題型:選擇題
用下列分離裝置進行相應實驗,能達到相應實驗目的的是( )

A.用圖I除去CO2中含有的少量Cl2
B.用圖Ⅱ蒸干NH4Cl飽和溶液制備NH4Cl晶體
C.用圖Ⅲ分離NaCl和Na2SO4的混合溶液
D.用圖Ⅳ分離CCl4萃取碘水中的碘后已分層的有機層和水層
查看答案和解析>>
科目:高中化學 來源:2016屆遼寧省高三全真模擬理綜化學試卷(解析版) 題型:選擇題
下列實驗中,對應的現象和結論都正確,且兩者具有因果關系的是( )
選項 | 實驗 | 現象 | 結論 |
A | 某溶液滴加過量的稀鹽酸 | 有刺激性氣味氣體產生,溶液中出現沉淀 | 溶液中一定存在S2-和SO32- |
B | 將BaSO4固體粉末加入飽和Na2CO3溶液中,攪拌,過濾,洗滌,在濾渣中加入稀鹽酸 | 產生氣體,濾渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
C | 將黑色氧化銅粉末進行高溫加熱 | 黑色變成紅色 | CuO分解成銅單質 |
D | 將少量大理石粉末加入1.0mol•L-1的NH4Cl溶液中 | 產生氣體,粉末溶解 | NH4Cl水解使溶液呈酸性 |
查看答案和解析>>
科目:高中化學 來源:2016屆江西省高三考前熱身理綜化學試卷(解析版) 題型:填空題
【化學——化學與技術】過氧化鈣可以用于改善地表水質、處理含重金屬粒子廢水和治理赤潮,也可用于應急供氧等。實驗室可用工業碳酸鈣(含MgCO3、FeCO3等雜質)制取純凈的碳酸鈣,然后再用純的碳酸鈣制取過氧化鈣,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水,加熱至350℃左右開始分解放出氧氣,425℃分解完全。
(1)寫出反應①中氧化還原反應的離子方程式:___________________________。
(2)向反應①后的溶液中加濃氨水的目的是:___________,________(用方程式表示)
(3)反應②常用冰水控制溫度在0℃左右,其可能原因是(寫出兩種):
①__________________________;②__________________________。
(4)測定產品中CaO2的含量的實驗步驟是
第一步:準確稱取a g產品于有塞錐形瓶中,加入適量蒸餾水和過量的b g KI晶體,再滴入少量2 mol/L的H2SO4溶液,充分反應。
第二步:向上述錐形瓶中加入幾滴淀粉溶液。
第三步:逐滴加入濃度為c mol·L-1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液V mL。已知:I2+2S2O===2I-+S4O。
某同學第一步和第二步的操作都很規范,第三步滴速太慢,這樣測得的CaO2的質量分數可能________(填“不受影響”“偏低”或“偏高”),原因是____________________.
查看答案和解析>>
科目:高中化學 來源:2016屆海南省高三考前模擬理綜化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A.淀粉、油脂和蛋白質都是高分子化合物,且它們均為混合物
B.煤、石油和天然氣都是化石燃料,且它們均不能再生
C.果糖和葡萄糖不能發生水解反應,蔗糖和麥芽糖都能發生水解反應
D.乙酸和葡萄糖都能與新制的 Cu(OH)2懸濁液反應,且反應類型均為氧化反應
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省高二6月月考化學試卷(解析版) 題型:選擇題
向某NaOH溶液中通入CO2氣體后得到溶液M,因CO2通入量的不同,溶液M的組成也不同。若向M中逐滴加入鹽酸,產生的氣體體積V(CO2)與加入鹽酸的體積V(HCl)的關系有如圖所示四種情況,且(2)、(3)、(4)圖中分別有OA:AB=2:3,OA=AB,OA:AB=3:2,則下列分析與判斷不正確的是(不計CO2的溶解)( )
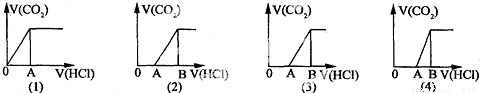
A.M中只有一種溶質的有(1)和(3)
B.M中有兩種溶質的有(2)和(4)
C.(2)圖顯示M中含有NaHCO3和Na2CO3兩種溶質,二者的物質的量之比為2:1
D.(4)圖顯示M中的溶質為NaOH和Na2CO3,二者的物質的量之比為1:2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com