

| n(CH3OH) |
| n(CO2) |
| 1-0.8 |
| 2 |
| 0.1mol/L |
| 10min |
| 0.1×0.1 |
| 0.4×13 |
| 0.8×0.8 |
| 1×23 |
| n(CH3OH) |
| n(CO2) |


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源: 題型:
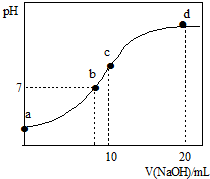 常溫下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH時,溶液的pH與所加NaOH溶液體積的關系如圖所示(不考慮揮發).下列說法正確的是( )
常溫下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH時,溶液的pH與所加NaOH溶液體積的關系如圖所示(不考慮揮發).下列說法正確的是( )| A、點a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B、點b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、點c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、點d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 容器 | A | B |
| 反應物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 反應能量變化 | 放出αkJ熱量 | 吸收19.6kJ熱量 |

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、7.8g Na2S和Na2O2的混合物中含有的陰離子數等于0.1NA |
| B、12.5mL 16mol?L-1濃硫酸與足量銅反應,轉移電子數為0.2NA |
| C、標準狀況下,4.48L N2所含的共用電子對數0.2NA |
| D、常溫下,1L 0.1mol?L-1的CH3COOH溶液中含有的H+數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、當陰極產物為銅時,陽極產物一定為氯氣 |
| B、當陽極產物為氯氣時,陰極上一定會析出銅 |
| C、整個過程中陽極先產生氯氣,后產生氧氣 |
| D、電解到最后階段,溶液中的溶質為硫酸鈉和硫酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com