
分析 在一定溫度下,將2.4molA和1.2molB兩種氣體相混合后于容積為2L的某密閉容器中,2min末反應達到平衡狀態,生成了0.8molD,并測得C的濃度為0.4mol/L,生成C為0.4mol/L×2=0.8mol,則:
A(g)+B(g)?xC(g)+D(g)
起始量(mol):2.4 1.2 0 0
變化量(mol):0.8 0.8 0.8 0.8
平衡量(mol):1.6 0.4 0.8 0.8
(1)物質的量之比等于化學計量數之比,則x=1,根據v=$\frac{△c}{△t}$計算v(B);
(2)A的轉化率=$\frac{物質的量變化量}{起始物質的量}$×100%;
(3)該反應達到平衡時,再向容器中加入1.2molA和0.6molB,等效為在原平衡基礎上增大壓強,反應前后氣體的體積不變,增大反應體系的壓強,平衡不移動;
(4)化學平衡常數是指:一定溫度下,可逆反應到達平衡時,生成物的濃度系數次冪之積與反應物的濃度系數次冪之積的比,固體、純液體不需要在化學平衡常數中寫出;
正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小;
(4)反應前后氣體的體積不變,增大反應體系的壓強,平衡不移動;
(5)反應前后氣體物質的量不變,用物質的量代替濃度代入K=$\frac{c(C)×c(D)}{c(A)×c(B)}$計算平衡常數,計算此時濃度商Qc,若Qc=K,處于平衡狀態,若Qc<K,反應向正反應進行,若Qc>K,反應向逆反應進行;
結合平衡常數計算平衡時D的濃度.
解答 解:在一定溫度下,將2.4molA和1.2molB兩種氣體相混合后于容積為2L的某密閉容器中,2min末反應達到平衡狀態,生成了0.8molD,并測得C的濃度為0.4mol/L,生成C為0.4mol/L×2=0.8mol,則:
A(g)+B(g)?xC(g)+D(g)
起始量(mol):2.4 1.2 0 0
變化量(mol):0.8 0.8 0.8 0.8
平衡量(mol):1.6 0.4 0.8 0.8
(1)物質的量之比等于化學計量數之比,所以0.8mol:0.8mol=x:1,解得x=1,
v(B)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L.min),
故答案為:1;0.2mol/(L.min);
(2)A的轉化率=$\frac{0.8mol}{2.4mol}$×100%=33.3%,
故答案為:33.3%;
(3)該反應達到平衡時,再向容器中加入1.2molA和0.6molB,等效為在原平衡基礎上增大壓強,反應前后氣體的體積不變,增大反應體系的壓強,平衡不移動,A的轉化率不變,
故答案為:不變;
(4)A(g)+B(g)?xC(g)+D(g)的化學平衡常數表達式K=$\frac{c(C)×c(D)}{c(A)×c(B)}$,
正反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小,450℃時平衡常數大于500℃時平衡常數,
故答案為:$\frac{c(C)×c(D)}{c(A)×c(B)}$;大于;
(5)反應前后氣體物質的量不變,用物質的量代替濃度計算平衡常數,則K=$\frac{c(C)×c(D)}{c(A)×c(B)}$=$\frac{0.8×0.8}{1.6×0.4}$=1,算此時濃度商Qc=$\frac{0.2×0.2}{0.4×0.4}$=0.25<K=1,反應向正反應進行,則v正>v逆,
設平衡時轉化的A為ymol,則:
A(g)+B(g)?C(g)+D(g)
起始量(mol):0.4 0.4 0.2 0.2
變化量(mol):y y y y
平衡量(mol):0.4-y 0.4-y 0.2+y 0.2+y
所以$\frac{(0.2+y)×(0.2+y)}{(0.4-y)×(0.4-y)}$=1,解得y=0.1
故平衡時D的濃度為$\frac{0.3mol}{2L}$=0.15mol/L,
故答案為:>;0.15mol/L.
點評 本題考查化學平衡計算與影響因素、平衡常數計算及應用等,注意理解掌握根據平衡常數與濃度商判斷反應進行方向.


 星級口算天天練系列答案
星級口算天天練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制備氫氧化鐵膠體 | |
| B. | 用量筒、試管、膠頭滴管、玻璃棒、蒸餾水和 pH試紙,可鑒別pH 相等的硫酸和醋酸 | |
| C. | 用FeSO4、NaOH和鹽酸等試劑在空氣中可以制備純凈的FeCl3溶液 | |
| D. | 用NaOH溶液和鹽酸可除去MgCl2溶液中混有的AlCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用純鋅和稀硫酸反應 | B. | 用含銅等的粗鋅和稀硫酸反應 | ||
| C. | 用純鋅和濃硫酸反應 | D. | 用含銅等的粗鋅和稀硝酸反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(aq)═2NaHCO3(aq)△H=-(8x+2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向碳酸氫鈣溶液中加過量氫氧化鈉Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等體積等物質的量濃度的氫氧化鋇溶液與碳酸氫銨溶液混合Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| C. | 氯化鋁與過量氨水反應 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 過量CO2通入氫氧化鋇的稀溶液中 CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定不存在Ag+和NO3- | B. | 一定存在CO32- | ||
| C. | 一定存在NO3-和Cl- | D. | 一定不存在NO3-、H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 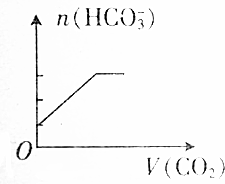 | B. | 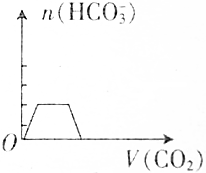 | ||
| C. | 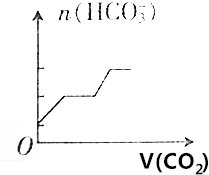 | D. | 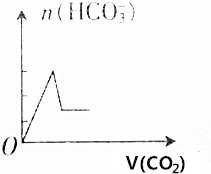 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗組 | 溫度 ℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com