
【題目】峨眉金頂攝身崖又稱舍身崖,因常現佛光而得名。“佛光”因攝入身之影像于其中,遂稱“攝身光”,為峨眉勝景之一。攝生崖下土壤中富含磷礦,所以在無月的黑夜可見到崖下熒光無數。
(1)“熒光”主要成分是 PH3(膦),其結構式為 __________ ,下列有關 PH3 的說法錯誤的是___________ 。
a.PH3 分子是極性分子
b.PH3 分子穩定性低于 NH3 分子,因為 N-H 鍵鍵能高
c.一個 PH3 分子中,P 原子核外有一對孤電子對
d.PH3 沸點低于 NH3 沸點,因為 P-H 鍵鍵能低
(2)PH3 的沸點比 NH3______填“高”或“低”) NH3 的水溶液堿性_____PH3 的水溶液堿性(填“大于”或“小于”);氯化鏻(PH4C1)與堿反應生成膦的離子方程式為 _______________________ 。
(3)PH3 是一種還原劑,其還原能力比 NH3 強,通常情況下能從Cu2+、Ag+、Hg2+等鹽溶液中還原出金屬, 而本身被氧化為最高氧化態。PH3 與 CuSO4 溶液反應的化學方程式為 ______________。
(4)“熒光”產生的原理是Ca3P2 在潮濕的空氣中劇烈反應,寫出該反應的化學方程式__________________。
(5)PH3 有毒,白磷工廠常用 Cu2+、Pd2+液相脫除 PH3:PH3+2O2![]() H3PO4,其他條件相同時, 溶解在溶液中O2 的體積分數與 PH3 的凈化效率與時間的關系如圖所示,回答下列問題:
H3PO4,其他條件相同時, 溶解在溶液中O2 的體積分數與 PH3 的凈化效率與時間的關系如圖所示,回答下列問題:
①由圖可知,富氧有利于______(選填“延長”或“縮短”)催化作用的持續時間。
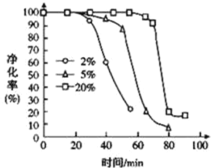
②隨著反應進行,PH3 的凈化效率急劇降低的原因可能為 _________________ 。
【答案】![]() cd 低 大于 PH4++OH-=PH3↑+H2O 4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4 Ca3P2+6H2O=3Ca(OH)2+2PH3↑ 延長 生成的磷酸能和金屬陽離子Cu2+、Pd2+反應,使催化效率降低
cd 低 大于 PH4++OH-=PH3↑+H2O 4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4 Ca3P2+6H2O=3Ca(OH)2+2PH3↑ 延長 生成的磷酸能和金屬陽離子Cu2+、Pd2+反應,使催化效率降低
【解析】
(1)PH3分子中P原子和每個H原子形成1個共價鍵,且P原子最外層還有一個孤電子對;
a.正負電荷中心不重合的分子為極性分子;
b.存在的化學鍵鍵能越大分子越穩定;
c.一個PH3分子中,P原子最外層有一對孤電子對;
d.含有氫鍵的氫化物熔沸點較高;
(2)因為NH3分子間存在氫鍵,沸點反常;因為氮的非金屬性比磷的非金屬性強,氮的電負性比磷的電負性強,在溶于水形成溶液時,一水合氨中的氮原子更容易吸引水中的氫離子而電離產生氫氧根使溶液堿性更強;氯化鏻(PH4C1)與堿反應生成膦的反應原理類似氯化銨與堿的反應;
(3)根據題意提示,PH3 是一種還原劑, 可將Cu2+鹽溶液還原生成金屬銅,而本身被氧化為最高氧化態H3PO4,據此寫出化學方程式;
(4)Ca3P2在潮濕的空氣中劇烈反應生成氫氧化鈣和PH3;
(5)①根據圖知,氧氣溶解分數越小,反應速率越快;
②生成的磷酸能和金屬陽離子反應。
(1)PH3分子中P原子通過3個共價鍵與3個H原子相結合,其結構式為![]() ;
;
a.PH3分子是三角錐型分子,正負電荷中心不重合的分子為極性分子,故a正確;
b.P原子的原子半徑大于N,形成磷氫鍵鍵能小于氮氫鍵鍵能,所以PH3 分子穩定性低于 NH3分子,故b正確;
c.一個 PH3分子中,P原子核外最外層有一對孤電子對,故c錯誤;
d.因為NH3分子間存在氫鍵,所以PH3 沸點低于NH3沸點,與鍵能無關,故d錯誤;
答案為:![]() ;cd;
;cd;
(2)因為NH3分子間存在氫鍵,所以PH3 沸點低于 NH3 沸點;因為氮的非金屬性比磷的非金屬性強,氮的電負性比磷的電負性強,在溶于水形成溶液時,一水合氨中的氮原子更容易吸引水中的氫離子而電離產生氫氧根使溶液堿性更強,所以NH3 的水溶液堿性大于PH3 的水溶液堿性;氯化鏻(PH4C1)與堿反應生成膦的反應原理類似氯化銨與堿的反應,其離子方程式為PH4++OH-=PH3↑+H2O;
綜上所述,故答案為:低;大于;PH4++OH-=PH3↑+H2O;
(3)根據題意提示,PH3 是一種還原劑, 可將Cu2+鹽溶液還原生成金屬銅, 而本身被氧化為最高氧化態H3PO4,所以PH3 與 CuSO4 溶液反應的化學方程式為4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4;
故答案為:4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4;
(4)Ca3P2類似于電石(CaC2),電石與水能發生類似水解的反應生成氫氧化鈣和乙炔,所以在潮濕的空氣中Ca3P2與水反應反應的方程式為Ca3P2+6H2O=3Ca(OH)2+2PH3↑;
故答案為:Ca3P2+6H2O=3Ca(OH)2+2PH3↑;
(5)①由圖可知,氧氣的體積分數越大,PH3高凈化率持續時間長,所以富氧有利于延長催化作用的持續時間;
故答案為:延長;
②由于隨著反應的進行,反應生成H3PO4與催化劑Cu2+、Pd2+反應,使催化效率降低,所以PH3 的凈化效率急劇降低;
故答案為:生成的磷酸能和金屬陽離子Cu2+、Pd2+反應,使催化效率降低。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】工業上將石灰石和硫煤混合使用,稱之為“固硫”,其反應原理為:2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
已知:CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
請回答下列問題:
(1)CaSO4(s)![]() CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
(2)T1℃時,向某恒容密閉容器中通入一定量的CO2和足量CaO發生反應:CaO(s)+CO2(g)![]() CaCO3(s),CO2的濃度隨時間變化如圖所示:
CaCO3(s),CO2的濃度隨時間變化如圖所示:
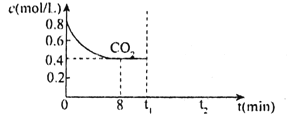
①0~8min,v(CO2)=___。
②t1min時,若保持其他條件不變,壓縮容器體積至原來的![]() ,t2min重新達到平衡,請在圖中畫出CO2的濃度自條件改變至新平衡的變化曲線___。
,t2min重新達到平衡,請在圖中畫出CO2的濃度自條件改變至新平衡的變化曲線___。
(3)T2℃時,向某密閉容器中通入2molSO2和1molO2發生反應:2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
①若該容器為恒壓密閉容器,下列選項可判斷反應已達平衡狀態的是___。
A.混合氣體的密度不再改變
B混合氣體的壓強不再改變
C.相同時間內,每斷裂0.1molO=O鍵,同時生成0.2molSO3
D.混合氣體的平均相對分子質量不再改變
②若該容器為2L的恒容密閉容器,達平衡時SO3的體積分數為40%,則O2的轉化率為___,T2℃時該反應的平衡常數K=___。
③反應達到②中的平衡狀態后,保持反應溫度和O2的濃度不變,增大容器體積,則平衡將___(填“正向”、“逆向”或“不“)移動,原因為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.無色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙變紅的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.氫氧燃料電池是符合綠色化學理念的新型發電裝置,如圖1為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:
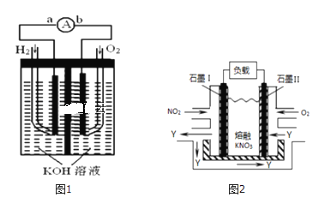
(1)負極反應式為______.
(2)電極表面鍍鉑粉的原因為______.
II.分析下列電解過程:
(1)寫出惰性電極電解CuSO4溶液的總反應的離子方程式:______;
(2)寫出惰性電極電解NaCl溶液的陽極反應式______;電解一段時間后加______(填物質名稱)恢復電解前狀況.
III.NO2、O2和熔融KNO3可制作燃料電池,其原理如圖2
(1)請寫出負極的電極方程式:______.
(2)相同條件下,放電過程中消耗的NO2和O2的體積比為______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家經過研究發現,CO2 與 H2 在催化劑作用下可轉化成 CH3OH 燃料,是一種減排、環保的有效方法。該可 逆反應發生過程中的能量變化如圖所示,下列說法錯誤的是

A.CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g)為吸熱反應
CO2(g)+3H2(g)為吸熱反應
B.使用催化劑 x 時,正反應的活化能 = △H + 逆反應活化能
C.其他條件一定,與其他催化劑相比,使用催化劑 z 時,反應物 轉化率可能更高
D.從圖中可知,選用不同的催化劑,反應的△H也不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】斑蝥黃是一種有機顏料,其結構如圖所示,下列說法正確的是

A.斑蝥黃的分子式為 C40H50O2
B.斑蝥黃的一氯代物可能存在 13 種結構(不考慮立體異構)
C.斑蝥黃能發生加成反應和酯化反應
D.斑蝥黃易溶于水和有機溶劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】垃圾分類正在全國逐漸推廣,垃圾資源化是可持續、綠色發展的重要途徑。由金屬廢料(主要含鐵、銅和它們的氧化物)制得堿式碳酸銅和摩爾鹽[(NH4)2SO4·FeSO4·xH2O]的工藝流程如圖所示:

已知:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=2.2×10-20,一般認為某離子濃度小于或等于10-5mol/L時,該離子轉化或去除完全。
請回答下列問題:
(1)熱純堿的作用是__,H2O2的電子式為__。
(2)調pH步驟可選用的試劑為__。
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22mol·L-1,則需要調節的pH范圍是__。
(4)溶液1經過加熱、蒸發至__時,自然冷卻即可得到晶體,然后抽濾,用酒精洗滌晶體,酒精洗滌的目的是__。
(5)寫出該流程中生成堿式碳酸銅的離子方程式__。
(6)取3.92g摩爾鹽產品,在隔絕空氣的條件下加熱至135°C時完全失去結晶水,此時固體質量為2.84g,則該摩爾鹽結晶水個數x=__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2和NaClO2均具有漂白性,工業上用ClO2氣體制NaClO2的工藝流程如圖所示。
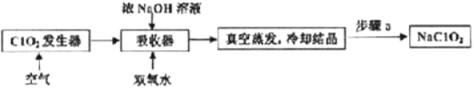
下列說法不正確的是
A.步驟a的操作包括過濾、洗滌和干燥
B.吸收器中生成NaClO2的離子方程式為2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工業上將ClO2氣體制成NaCIO2固體,其主要目的是便于貯存和運輸
D.通入的空氣的目的是驅趕出ClO2,使其被吸收其充分吸收
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com