
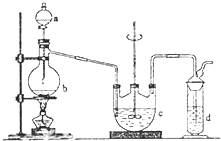
 在實驗室中可通過如下反應制取硫代硫酸鈉Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2
在實驗室中可通過如下反應制取硫代硫酸鈉Na2S2O3:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2

 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、向Ag2CrO4的濁液中加入AgNO3溶液,Ag2CrO4的Ksp減小 |
| B、將0.001 mol?L-1的AgNO3溶液逐滴加入到含Cl-和CrO42-濃度均為0.001 mol?L-1的溶液中,則先產生AgCl沉淀 |
| C、飽和AgCl溶液與飽和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| D、該溫度下,AgCl在水中的溶解度小于在食鹽水中的溶解度 |
查看答案和解析>>
科目:高中化學 來源: 題型:
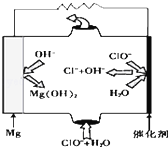 完成下列熱化學方程式(化學方程式、電極反應式、表達式等)的書寫:
完成下列熱化學方程式(化學方程式、電極反應式、表達式等)的書寫:查看答案和解析>>
科目:高中化學 來源: 題型:
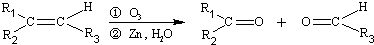 (R1、R2、R3代表烴基)
(R1、R2、R3代表烴基)
 :
:
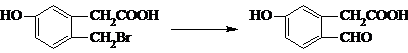
 屬芳香醚,其同系物的通式為:
屬芳香醚,其同系物的通式為:
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、Ksp與溫度有關 |
| B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定條件下可轉化為CuS沉淀 |
| C、向AgCl沉淀的溶解平衡中加入NaCl固體,AgCl平衡不移動 |
| D、若在Ca(OH)2溶液與FeCl2溶液中加足量稀硝酸,無沉淀產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:
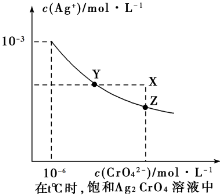
| A、在t℃時,Ag2CrO4的Ksp為1×10-9 |
| B、在飽和Ag2CrO4溶液中加入K2CrO4可使溶液由Y點到X點 |
| C、在t℃時,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/LKCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
| D、在t℃時,反應Ag2CrO4(s)+2 Cl-(aq)?2AgCl(s)+CrO42-(aq)的平衡常數K=2.5×107 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com