
分析 (1)根據蓋斯定律結合熱化學方程式計算所需熱化學方程式;
(2)利用化學平衡三行式解答,設平衡時CO轉化x mol•L-1;
2H2(g)+CO(g)?CH3OH(l)
起始時各物質濃度(mol•L-1 ) 1.5 1 0
變化濃度(mol/L) 2x x x
平衡時各物質濃度(mol•L-1 ) 1.5-2x 1-x x
依題意有達到平衡時,測得容器內的壓強是反應前壓強的$\frac{3}{5}$,
1.5-2x+1-x+x=$\frac{3}{5}$×2.5
x=0.5,平衡常數等于生成物平衡濃度冪次方乘積除以反應物平衡濃度冪次方乘積;
(3)利用Q與K的關系判斷,Q=K,達到平衡,Q>K向逆向進行,Q<K向正向進行.
解答 解:(1)根據蓋斯定律:①-②×$\frac{1}{2}$得CO(g)和H2(g)合成1mol液態甲醇的熱化學反應方程式:2H2(g)+CO(g)=CH3OH(l)△H =+131.9 kJ/mol;
故答案為:2H2(g)+CO(g)=CH3OH(l)△H =+131.9 kJ/mol;
(2)設平衡時CO轉化x mol•L-1;
2H2(g)+CO(g)?CH3OH(l)
起始時各物質濃度(mol•L-1 ) 1.5 1 0
變化濃度(mol/L) 2x x x
平衡時各物質濃度(mol•L-1 ) 1.5-2x 1-x x
依題意有達到平衡時,測得容器內的壓強是反應前壓強的$\frac{3}{5}$,
1.5-2x+1-x+x=$\frac{3}{5}$×2.5
x=0.5
平衡常數K=$\frac{x}{(1.5-x)^{2}(1-x)}$=$\frac{0.5}{0.{5}^{2}×0.5}$=4
答:該溫度下反應的平衡常數為4;
(3)該反應的平衡常數表達式為:K=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})c(CO)}$,在恒溫恒容的條件下,向(2)達到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)濃度均為原平衡的2倍,則Q=$\frac{2c(C{H}_{3}OH)}{2c(CO){c}^{2}({H}_{2})}$=K,平衡不移動,選C.
故答案為:C.
點評 本題考查了化學平衡計算應用,主要是平衡常數、轉化率的計算,平衡移動原理和平衡影響因素分析是解題關鍵,題目難度中等.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:選擇題
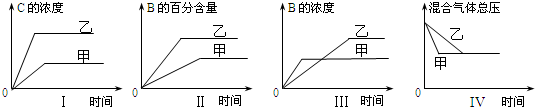
| A. | 圖I研究的是不同催化劑對反應的影響,且乙使用的催化劑效率較高 | |
| B. | 圖Ⅱ研究的是壓強對反應的影響,且乙的壓強較高 | |
| C. | 圖Ⅲ研究的是溫度對反應的影響,且甲的溫度較高 | |
| D. | 圖IV 研究的是不同催化劑對反應的影響,且甲使用的催化劑效率較高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H2 C2H6 | B. | CH4 C3H8 | C. | C3H6 C3H8 | D. | C2H4 C4H8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Al>Mg>Na | B. | 熱穩定性:NH3>PH3>H2S | ||
| C. | 酸性:HClO4>H2SiO3>H3PO4 | D. | 元素非金屬性:F>O>N |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 在新裝修的室內擺放適宜的花卉--改善室內空氣質量 | |
| B. | 限制生產、使用含磷洗滌劑--防止出現“臭氧空洞” | |
| C. | 嚴禁排放未經處理的有毒工業廢水--防止水土流失 | |
| D. | 給汽車安裝尾氣凈化裝置--減少氮的氧化物及一氧化碳的排放 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | B與D形成的單質分別為甲、乙,非金屬性:B>D,活潑性:乙>甲 | |
| B. | 1mol E2C2與足量水完全反應生成C的單質,共轉移2mol電子 | |
| C. | 原子半徑:D>E>A>B>C | |
| D. | C的最簡單氫化物的沸點比B的最簡單氫化物的沸點低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 著色劑--苯甲酸鈉 | B. | 調味劑--亞硝酸鈉 | ||
| C. | 營養強化劑--糧食制品中加賴氨酸 | D. | 防腐劑--莧菜紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,消去反應
,消去反應 ,取代反應
,取代反應 ,取代反應.
,取代反應.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com