
分析 (1)在水溶液里或熔融狀態下能導電的化合物是電解質,在溶液里全部電離的電解質是強電解質;
(2)氟化氫在溶液中部分電離出氫離子和氟離子;
(3)氫氧化鐵為弱堿,在溶液中部分電離出鐵離子和氫氧根離子;
(4)NaHSO4在熔融狀態下電離出鈉離子和硫酸氫根離子;
(5)酸性高錳酸鉀溶液具有強氧化性,能夠將醋酸氧化成二氧化碳氣體和水.
解答 解:(1)在溶液里全部電離的電解質是強電解質,6種物質中能夠在溶液中完全電離的電解質有:①干燥的食鹽晶體 ②液態氯化氫,
故答案為:①②;
(2)HF為弱電解質,在溶液中部分電離,其電離方程式為:HF?H++F-或HF+H2O?H3O++F-,
故答案為:HF?H++F-或HF+H2O?H3O++F-;
(3)Fe(OH)3為弱堿,存在電離平衡,則氫氧化鐵水中的電離方程式為:Fe(OH)3?Fe3++3OH-,
故答案為:Fe(OH)3?Fe3++3OH-;
(4)NaHSO4在熔融狀態下完全電離出鈉離子和硫酸氫根離子,其電離方程式為:NaHSO4═Na++HSO4-,
故答案為:NaHSO4═Na++HSO4-;
(5)草酸(H2C2O4)和酸性高錳酸溶液發生氧化還原反應,反應的離子反應方程式為:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案為:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
點評 本題考查較為綜合,涉及離子方程式、電離方程式、強弱電解質的判斷等知識,題目難度中等,明確離子方程式的書寫原則為解答關鍵,注意掌握強弱電解質的概念,試題培養了學生的靈活應用能力.


科目:高中化學 來源: 題型:實驗題
 鄭州一中是一所具有豐厚的歷史積淀、獨特的精神內涵,以關注學生智慧與靈魂為學校文化內核,充滿創新精神,能夠培養具有國際視野的拔尖人才,擁有核心競爭力的國內名校.目前一中教育集團包含小學部、初中部、高中部三個學部的十余所學校.學校以主體課堂教學為載體,以培養學生的創新思維和實踐能力為目標,在教學活動中特別注重學生科學素養的提升,如對于I A和ⅥA族重要元素化合物的性質,各校區根據實際情況開展了豐富多彩的探究活動.
鄭州一中是一所具有豐厚的歷史積淀、獨特的精神內涵,以關注學生智慧與靈魂為學校文化內核,充滿創新精神,能夠培養具有國際視野的拔尖人才,擁有核心競爭力的國內名校.目前一中教育集團包含小學部、初中部、高中部三個學部的十余所學校.學校以主體課堂教學為載體,以培養學生的創新思維和實踐能力為目標,在教學活動中特別注重學生科學素養的提升,如對于I A和ⅥA族重要元素化合物的性質,各校區根據實際情況開展了豐富多彩的探究活動. .
.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗序號 | H2C2O4溶液 | KMnO4溶液 | 溫度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

 ,在該反應中濃鹽酸表現了還原性和酸性.
,在該反應中濃鹽酸表現了還原性和酸性.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
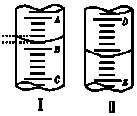 如圖,圖Ⅰ表示10mL量筒中液面的位置,A與B、B與C刻度間相差1mL,圖II表示50mL滴定管中液面的位置,D 與E刻度間相差1mL.如果刻度A和D都是10,則兩處液面的讀數是( )
如圖,圖Ⅰ表示10mL量筒中液面的位置,A與B、B與C刻度間相差1mL,圖II表示50mL滴定管中液面的位置,D 與E刻度間相差1mL.如果刻度A和D都是10,則兩處液面的讀數是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com