
【題目】電解原理在化學工業中有廣泛應用。如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
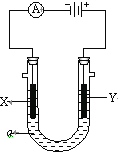
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則:
①Y電極上的電極反應式為___;在X極附近觀察到的實驗現象是___;
②電解總反應的離子方程式:____。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是___;電極反應式是___。
②Y電極的材料是___;電極反應式是___。
(說明:雜質發生的電極反應不必寫出)
【答案】2Cl-﹣2e-=Cl2↑ 放出氣體、溶液變紅色 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 精銅 Cu2++2e-=Cu 粗銅 Cu-2e-=Cu2+
Cl2↑+H2↑+2OH- 精銅 Cu2++2e-=Cu 粗銅 Cu-2e-=Cu2+
【解析】
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,Y電極上氯離子放電生成氯氣,氯氣可以用濕潤的淀粉碘化鉀試紙檢驗,X電極上氫離子放電,同時該電極附近生成氫氧根離子;
(2)根據電解精煉銅的工作原理知識來回答。
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,和電源的負極相連的電極X極是陰極,該電極上氫離子發生得電子的還原反應,即2H++2e-=H2↑,所以該電極附近氫氧根濃度增大,堿性增強,滴入幾滴酚酞試液會變紅;
①Y電極上氯離子放電生成氯氣,電極反應式為2Cl--2e-=Cl2↑;
②X電極上氫離子放電,同時該電極附近生成氫氧根離子,Y電極上氯離子放電生成氯氣,所以電池反應式為2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)①電解方法精煉粗銅,電解池的陰極材料是精銅,電極反應為:Cu2++2e-=Cu;
②電解方法精煉粗銅,電解池的陽極材料是粗銅,電極反應為:Cu-2e-=Cu2+。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】(1)寫出COS的電子式__________________,C與O形成共價鍵時,共用電子對會偏向__________原子,判斷依據是___________。
(2)已知COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/mol
CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol
寫出H2S與CO反應生成COS的熱化學方程式__________________________________。
100℃時將CO與H2S按物質的量比為1∶1充入反應器中,達平衡后CO的轉化率α=33.3%,此時反應的平衡常數k=________________________。
(3)在充有催化劑的恒壓密閉容器中進行反應。設起始充入的n(CO)∶n(H2S)=m,相同時間內測得H2S轉化率與m和溫度(T)的關系如圖所示。
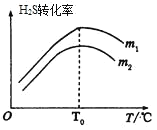
①m1________m2(填>、<或=)
②溫度高于T0時,H2S轉化率減小的可能原因為_________
a.反應停止了 b.反應的△H變大
c.反應達到平衡 d.催化劑活性降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸錳是一.種重要的化工原料,在農業、電化學和建筑等領域均有廣泛應用。以含錳廢料(含有MnO2 、CuO、Fe和少量CaO)為原料制備MnSO4的一種流程如下:
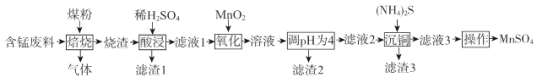 已知:
已知:
I .燒渣中含有MnO、CuO、Cu、Fe、CaO。
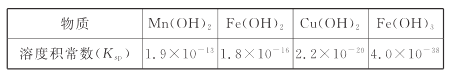
II.難溶電解質的溶度積常數如下表所示:
回答下列問題:
(1)“焙燒”過程加入煤粉的主要作用為___________________________。
(2)“酸浸”時所加稀H2SO4不宜過量太多的原因為______________________________.濾渣1的主要成分為_____________________(填化學式)。
(3)“氧化”過程中主要反應的離子方程式為__________________。
(4)“調pH為4”的目的為______________________;若“溶液”中c(Cu2+ )=0.022 mol/L,“濾液2”的體積是“溶液”體積的2倍,則“調pH為4”時Cu2+是否開始沉淀____________(通過計算說明)。
(5)(NH4)2S的電子式為___________________。
(6)已知:(NH4)2SO4與MnSO4的溶解度曲線如圖所示。“操作”主要包括蒸發濃縮_______、過濾 、洗滌、干燥;其中用乙醇代替水洗滌的原因為__________,需控制溫度為____( 填選項字母)得到產品最多。
A.10°C B.40 °C C.60 °C D.100°C
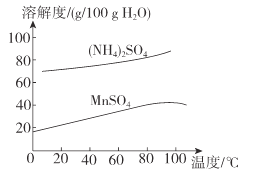
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】肼(N2H4)和氨均為重要的化工原料。回答下列問題:
已知:I.N2H4(l)+O2(g)![]() N2(g)+2H2O(l) △H=-624.0 kJ/mol
N2(g)+2H2O(l) △H=-624.0 kJ/mol
II.N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
III.2NH3(g)![]() N2H4(l)+H2(g) △H=+144.8 kJ/mol
N2H4(l)+H2(g) △H=+144.8 kJ/mol
(1)H2的燃燒熱△H=_____________。
(2)T1 °C時,向恒容的密閉容器中加入1 mol N2H4和1 mol O2,發生反應I。達到平衡后,只改變下列條件,能使N2的平衡體積分數增大的是_______( 填選項字母)。
A.增大壓強 B.再通入一定量O2
C.分離出部分水 D.降低溫度
(3)在恒壓絕熱的密閉容器中通入一定量的N2和H2,發生反應II和反應III。反應III對N2的平衡轉化率的影響為_____(填“增大”“減小”或“無影響”),理由為___________。
(4)t2°C時,向剛性容器中充入NH3,發生反應III。NH3和H2的分壓(p)與時間(t)的關系如圖所示。
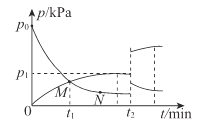
①0~t1min內,反應的平均速率v(NH3)=____kPa/min
②反應的平衡常數Kp=______kPa-1 (Kp為用分壓表示的平衡常數)。
③反應物分子的有效碰撞幾率:M____N(填“>”“<”或“=”)。
④t2 min時升高溫度,再次達到平衡后,H2的分壓增大的原因為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將某一元酸HA和NaOH溶液等體積混合,兩種溶液的濃度和混合后所得溶液的pH如下表,請回答:
實驗編號 | HA物質的量濃度(molL-1) | NaOH物質的量濃度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考慮其它組的實驗結果,單從甲組情況分析,用a來說明HA是強酸還是弱酸___。
(2)不考慮其它組的實驗結果,單從乙組情況分析,c是否一定等于0.2___(選填“是”或“否”).混合液中離子濃度c(A-)與c(Na+)的大小關系是___。
(3)丙組實驗結果分析,HA是___酸(選填“強”或“弱”)。該混合溶液中離子濃度由大到小的順序是___。
(4)丁組實驗所得混合溶液中由水電離出的c(OH-)=___molL-1。寫出該混合溶液中下列算式的精確結果(不能做近似計算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W為短周期元素,它們在周期表中相對位置如圖所示。若Y原子的最外層電子是內層電子數的3倍,下列說法正確的是 ( )
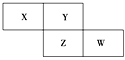
A. 原子半徑:W>Z>XB. 非金屬性:Z>Y
C. 最高化合價:X>ZD. 最高價氧化物對應水化物的酸性:W>Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗設計能夠成功的是( )
A.檢驗 Na2O2試樣是否變質為 Na2CO3:向試樣中加入鹽酸,產生無色無味的氣體
B.檢驗某鹵代烴是否是氯代烴: 試樣 ![]() 冷卻
冷卻![]()
![]() 出現白色沉淀
出現白色沉淀
C.除去溴乙烷中混有的溴:混合液![]()
![]() 溶液分層
溶液分層![]() 得下層
得下層
D.鑒定鹽 A 的成分是 FeBr2:
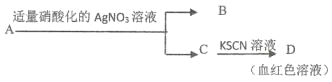
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯氧磷(POCl3)廣泛用于農藥、醫藥等生產。工業制備三氯氧磷的過程中會產生副產品亞磷酸(H3PO3)。回答下列問題:
(1)三氯氧磷可由三氯化磷、水、氯氣加熱反應生成,反應的化學方程式為_______
(2)已知亞磷酸(H3PO3)為二元弱酸,則Na2HPO3溶液中,各離子濃度的大小關系為_______
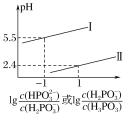
(3)常溫下,將NaOH溶液滴加到亞磷酸(H3PO3)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示,則表示lg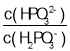 的是曲線_____(填“Ⅰ”或“Ⅱ”),亞磷酸(H3PO3)的Ka1=_____,反應HPO32-+H2O
的是曲線_____(填“Ⅰ”或“Ⅱ”),亞磷酸(H3PO3)的Ka1=_____,反應HPO32-+H2O![]() H2PO3-+OH-的平衡常數的值是_____。
H2PO3-+OH-的平衡常數的值是_____。
(4)工業上生產三氯氧磷的同時會產生含磷廢水(主要成分為H3PO4、H3PO3)。向廢水中先加入適量漂白粉,再加入生石灰調節pH,將磷元素轉化為磷酸的鈣鹽沉淀并回收。若處理后的廢水中c(Ca2+)=5×10-6 mol·L-1,則溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E五種元素是周期表中前四周期元素,且原子序數依次增大。其中A、B、C為同周期的非金屬元素,且B、C原子中均有兩個未成對電子。D、E為同周期元素且分別位于s區和d區。五種元素所有的s能級電子均為全充滿。E的d能級電子數等于A、B、C最高能層的p能級電子數之和。
回答下列問題:
(1)五種元素中,電負性最大的是________(填元素符號)。
(2)E常有+2、+3兩種價態,畫出E2+的價電子排布圖:________________。
(3)與BC互為等電子體的分子、離子分別是______________________(各舉1例),BC的結構式為______________(若有配位鍵,須用“→”表示出來),實驗測得該分子的極性極弱,試從結構方面進行解釋:________________________________________________。
(4)自然界中,含A的鈉鹽是一種天然礦藏,其化學式寫作Na2A4O7·10H2O,實際上它的結構單元是由2個H3AO3和2個[A(OH)4]-縮合而成的雙六元環,應該寫成Na2[A4O5(OH)4]·8H2O,其結構式如圖1所示,它的陰離子可形成鏈狀結構。
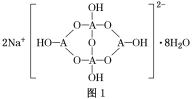
①A原子的雜化方式為________。
②Na2[A4O5(OH)4]·8H2O的陰離子由極性鍵和配位鍵構成,請在圖中用“→”標出其中的配位鍵________。該陰離子通過________________相互結合形成鏈狀結構。
③已知H3AO3為一元弱酸,根據上述信息,用離子方程式解釋分析H3AO3為一元酸的原因:________________________________________________________________________。
(5)E2+在水溶液中以[E(H2O)6]2+形式存在,向含E2+的溶液中加入氨水,可生成[E(NH3)6]2+,[E(NH3)6]2+更穩定,原因是_____________________________。
(6)由元素B、D組成的某離子化合物的晶胞結構如圖2所示,則該物質的電子式為_____。若晶胞的長、寬、高分別為520 pm、520 pm和690 pm,該晶體的密度為________(保留小數點后兩位數字)g·cm-3。
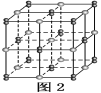
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com