
【題目】常溫下,將某一元酸HA和NaOH溶液等體積混合,兩種溶液的濃度和混合后所得溶液的pH如下表,請回答:
實驗編號 | HA物質的量濃度(molL-1) | NaOH物質的量濃度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考慮其它組的實驗結果,單從甲組情況分析,用a來說明HA是強酸還是弱酸___。
(2)不考慮其它組的實驗結果,單從乙組情況分析,c是否一定等于0.2___(選填“是”或“否”).混合液中離子濃度c(A-)與c(Na+)的大小關系是___。
(3)丙組實驗結果分析,HA是___酸(選填“強”或“弱”)。該混合溶液中離子濃度由大到小的順序是___。
(4)丁組實驗所得混合溶液中由水電離出的c(OH-)=___molL-1。寫出該混合溶液中下列算式的精確結果(不能做近似計算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1
【答案】若a=7,則HA是強酸;若a>7,則HA是弱酸 否 c(A-)=c(Na+) 弱 c(Na+)>c(A-)>c(OH-)>c(H+) 10-5 10-5-10-9 1×10-9
【解析】
(1)酸堿恰好完全反應,如反應后呈中性,則pH=7,為強酸,如pH>7,則為弱酸;
(2)若HA為強,則C等于0.2,若HA為弱酸,則C大于0.2,所以C不一定為0.2,結合電荷守恒判斷;
(3)pH>7,所以HA是弱酸,得到的溶液為0.05mol/L的HA和0.05mol/L的NaH的混合液;
(4)所得混合溶液為濃度為0.05mol/L的NaA溶液,其pH為9,促進水的電離,OH-全部為水電離,以此可計算濃度,溶液中存在電荷守恒和質子守恒。
(1)不考慮其它組的實驗結果,單從甲組情況分析,若a=7,則HA是強酸;若a>7,則HA是弱酸;
(2)不考慮其它組的實驗結果,單從乙組情況分析,pH=7,若HA為強酸,則C等于0.2,若HA為弱酸,則C大于0.2,所以C不一定為0.2,溶液中存在電荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),因pH=7,則c(OH-)=c(H+),則c(A-)=c(Na+);
(3)HA物質的量濃度為0.2mol/L,而NaOH物質的量濃度為0.1mol/L,pH>7,所以HA是弱酸,丙組得到的溶液為0.05mol/L的HA和0.05mol/L的NaH的混合液,根據電荷守恒可以得到c(OH-)+c(A-)=c(Na+)+c(H+),由于pH>7,所以c(OH-)>c(H+),即c(Na+)>c(A-),所以混合溶液中離子濃度由大到小的順序是c(Na+)>c(A-)>c(OH-)>c(H+);
(4)丁組實驗所得混合溶液為濃度為0.05mol/L的NaA溶液,其pH為9,促進水的電離,OH-全部為水電離,溶液的pH=9,則氫離子濃度為10-9 mol/L,等物質的量的酸堿反應后溶液呈堿性,溶液中氫氧根離子全部來自于弱酸根離子水解得到的,c(OH-)=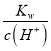 =
=![]() mol/L=10-5mol/L;一元酸HA和NaOH溶液等體積混合生成NaA溶液,溶液中存在電荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),依據上述計算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol/L;溶液中存在質子守恒,c(OH-)=c(HA)+c(H+),則c(OH-)-c(HA)=c(H+)=1×10-9mol/L。
mol/L=10-5mol/L;一元酸HA和NaOH溶液等體積混合生成NaA溶液,溶液中存在電荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),依據上述計算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol/L;溶液中存在質子守恒,c(OH-)=c(HA)+c(H+),則c(OH-)-c(HA)=c(H+)=1×10-9mol/L。


 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種高效的漂白劑和氧化劑,可用氯酸鈉(NaClO3)為原料制取,(常溫下ClO2為氣態),下列說法錯誤的是
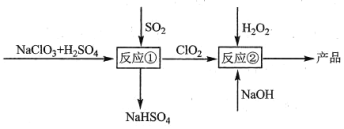
A.反應①階段,參加反應的NaClO3和SO2的物質的量之比為2:1
B.反應①后生成的氣體要凈化后進入反應②裝置
C.升高溫度,有利于反應②提高產率
D.反應②中有氣體生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某項目小組同學發現某一種胃藥片的止酸劑為碳酸鈣,為了測定其中止酸劑的質量特制定了如下操作步驟:
①配制0.2mol·L-1的HCl溶液和0.2mol·L-1的NaOH溶液;②每次取一粒(藥片質量均相同)0.2g的此胃藥片,磨碎后放入錐形瓶中再加入20mL蒸餾水;③以酚酞作指示劑,用0.2mol·L-1的NaOH溶液滴定,需用去VmL達滴定終點;④加入25mL0.2mol·L-1的HCl溶液。
(1)寫出全部實驗過程的操作步驟的順序:__。
(2)如圖所示的儀器中配制0.2mol·L-1的HCl溶液和0.2mol·L-1NaOH溶液肯定不需要的儀器是__(填序號),配制上述溶液還需用到的玻璃儀器是__(填儀器名稱)。

(3)配制上述溶液應選用的容量瓶的規格分別為__(填字母)。
A.50mL、50mL B.100mL、100mL
C.100mL、150mL D.250mL、250mL
(4)配制過程中,下列情況會使配制結果偏高的是__(填序號)。
A.洗凈后容量瓶內還殘留蒸餾水未烘干
B.量取濃鹽酸時,仰視刻度線觀察液面
C.定容時,仰視刻度線
D.定容后,加蓋倒轉搖勻后,發現液面低于刻度線又加水至刻度線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組從富含NaBr的工業廢水中提取Br2的過程主要包括:氧化、萃取、分液、蒸餾等步驟。已知:可能用到的數據信息和裝置如下。
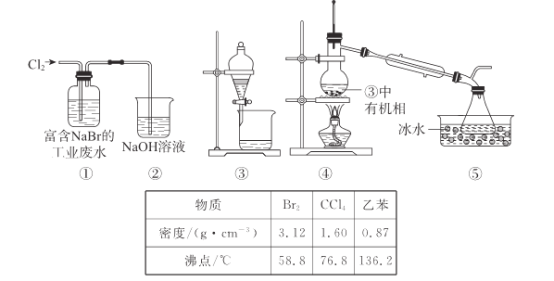
下列說法錯誤的是
A.實驗時,①的廢水中出現紅色
B.②的作用是吸收尾氣,防止空氣污染
C.用③進行萃取時,選擇CCl4比乙苯更合理
D.④中溫度計水銀球低于支管過多,導致Br2的產率低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Li、Fe、As均為重要的合金材料,NA為阿伏加德羅常數的值。回答下列問題:
(1)基態Li原子核外電子占據的空間運動狀態有________個,占據最高能層電子的電子云輪廓圖形狀為_________。
(2)Li的焰色反應為紫紅色,很多金屬元素能產生焰色反應的原因為_________。
(3)基態Fe3+比基態Fe2+穩定的原因為____________。
(4)KSCN和K4[Fe(CN)6]均可用于檢驗Fe3+。
①SCN-的立體構型為_______,碳原子的雜化方式為_____________。
②K4[Fe(CN)6]中所含元素的第一電離能由大到小的順序為__________(用元素符號表示);1 mol [Fe(CN)6]4-中含有σ鍵的數目為____________。
(5)H3AsO3的酸性弱于H3AsO4的原因為____________________。
(6)Li、Fe和As可組成一種新型材料,其立方晶胞結構如圖所示。若晶胞參數為a nm,阿伏加德羅常數的值為NA,則該晶體的密度可表示為______g●cm-3。(列式即可)
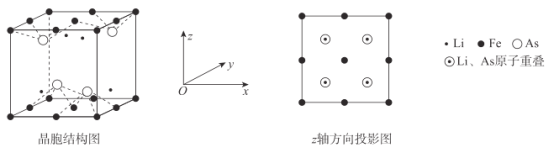
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
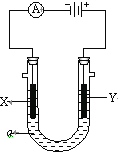
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則:
①Y電極上的電極反應式為___;在X極附近觀察到的實驗現象是___;
②電解總反應的離子方程式:____。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是___;電極反應式是___。
②Y電極的材料是___;電極反應式是___。
(說明:雜質發生的電極反應不必寫出)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷、硫、氯、砷等是農藥中的重要組成元素。回答下列問題:
(1)基態砷原子的核外價電子排布式為_______________ 。
(2)生產農藥的原料 PSCl3 中 P、S、Cl 的第一電離能由大到小的順序為____電負性由大到小的順序為__________________________。
(3)H2SO4為粘稠狀 難揮發性的酸 ,而 HNO3 是易揮發的酸,其原因是__________
(4)COS(羰基硫)可用作糧食的熏蒸劑,其中碳原子的雜化軌道類型為________,所含共價 鍵的類型為_____________,N2O與CO2互為等電子體 ,且N2O 分子中O只與一個N相連,則N2O的電子式為_______________ 。
(5)AlP 因殺蟲效率高、廉價易得而被廣泛應用。已知AlP的熔點為2000℃ ,其晶胞結構如圖所示。

①磷化鋁的晶體類型為 _____________________ 。
②A、B 點的原子坐標如圖所示,則C點的原子坐標為 __________________ 。
③磷化鋁的晶胞參數a = 546.35 pm(l pm=10—12 m), 其密度為________g/cm3( 列出計算式即可,用NA表示阿伏加德羅常數的數值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向0.10 mol·L-1的Na2CO3溶液中逐滴加入稀鹽酸,加入的HCl與原溶液中Na2CO3的物質的量之比f[f=![]() ]與混合液pH的關系如圖所示。下列說法正確的是( )
]與混合液pH的關系如圖所示。下列說法正確的是( )

A.f=0時,溶液中:c(Na+)=2c(![]() )
)
B.f=0.5時,溶液中:c(![]() )>c(
)>c(![]() )
)
C.f=1時,溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.f=2時,溶液中:![]() c(Na+)=c(
c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用CO合成甲醇的化學方程式為:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示.下列說法正確的是( )
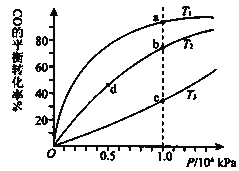
A.溫度:T1>T2>T3
B.正反應速率:v(a)>v(c) v(b)>v(d)
C.平衡常數:K(a)>K(c) K(b)=K(d)
D.平均摩爾質量M(a)<M(c) M(b)>M(d)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com