
| A. | 食用加碘鹽可預防碘缺乏癥,加碘鹽中加的含碘物質是碘單質 | |
| B. | 因為NaCl的水溶液能導電,所以NaCl溶液屬于強電解質 | |
| C. | 電解熔融NaCl得到23.0g金屬鈉時能產生22.4 L氯氣(標準狀況下) | |
| D. | 37Cl 是氯元素的一種同位素,23Na37Cl中質子數和中子數之比是7:8 |
分析 A.食用加碘鹽可預防碘缺乏癥,加碘鹽中加的含碘物質是碘酸鉀;
B.電解質是化合物,NaCl溶液是混合物;
C.利用電解反應中氯化鈉的物質的量來計算電解產物的量即可解答;
D.23Na37Cl中質子數和中子數分別是28和32.
解答 解:A.食用加碘鹽可預防碘缺乏癥,加碘鹽中加的含碘物質是碘酸鉀,故A錯誤;
B.電解質是化合物,NaCl溶液是混合物,不屬于電解質,故B錯誤;
C.得到23g金屬鈉,則需要電解58.5g熔融的NaCl,能產生0.5mol×22.4L/mol=11.2L氯氣(標準狀況),而不是22.4L氯氣,故C錯誤;
D.23Na37Cl中質子數和中子數分別是28和32,所以質子數和中子數之比是7:8,故D正確;
故選D.
點評 本題考查較為綜合,涉及物質的量的計算、強弱電解質判斷、原子構成等知識,題目難度不大,注意掌握強弱電解質的概念及判斷方法,明確質量數與質子數、中子數的關系,試題培養了學生的靈活應用能力.


科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
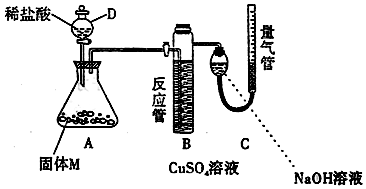
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在一固定容積的密閉容器中,進行如下反應:CO+H2O(g)?CO2+H2.其化學平衡常數K與溫度T的關系如表:
在一固定容積的密閉容器中,進行如下反應:CO+H2O(g)?CO2+H2.其化學平衡常數K與溫度T的關系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10mL pH=13的氨水與10mL pH=l的鹽酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | l0 mL0.1 mol/L NH4Cl溶液與5mL 0.2mol/LNaOH溶液混合:c(Cl-)=c(Na+)>c(OH-)>(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液與10 mL pH=13的NaOH溶液混合:c(CH3COO-)=c(Na+)>c(OH-)>c(H+) | |
| D. | l0 mL 0.5mol/L CH3COONa溶液與6mL pH=0的鹽酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
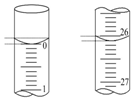 某學生用0.100 0mol/L的NaOH標準溶液滴定未知濃度的鹽酸,其操作可分為如下幾步:
某學生用0.100 0mol/L的NaOH標準溶液滴定未知濃度的鹽酸,其操作可分為如下幾步:| 滴定 次數 | 鹽酸溶液/mL | 0.100 0mol•L-1NaOH的體積(mL) | ||
| 滴定前 | 滴定 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①Ⅰ | B. | ②Ⅱ | C. | ③Ⅲ | D. | ④Ⅱ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com