
分析 (1)計算中心原子價層電子對數、孤電子對數,進而確定分子構型;
(2)氯化鐵熔沸點較低,應為分子晶體;同種元素含氧酸,該元素化合價越高,其酸性越強,非羥基氧越多,酸性越強;
(3)原子序數小于36的元素Q和T,在周期表中既處于同一周期又位于同一族,且原子序數T比Q多2,則Q為Fe、T為Ni;
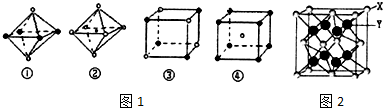
(4)NaCl屬于立方晶體,每個鈉離子周圍有6個氯離子、每個氯離子周圍有6個鈉離子;
(5)[Cu(NH3)4]2+中銅離子與氮原子之間形成配位鍵,氨氣分子中N原子與H原子之間形成極性鍵;
[Cu(NH3)4]2+中的兩個NH3被兩個Cl-取代能得到兩種不同結構的產物,[Cu(NH3)4]2+的空間構型為平面正方形;
(6)根據均攤法計算晶胞中X、Y原子數目,進而計算晶胞的質量,根據m=ρV計算晶胞體積,進而計算晶胞棱長x.Y原子與周圍4個X原子形成正四面體結構,令Y與X之間的距離為y,則正四面體中心到底面中心的距離為$\frac{y}{3}$,正四面體的高為$\frac{4}{3}$y,正四面體棱長=$\frac{\sqrt{2}x}{2}$,則正四面體側面的高為$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到邊的距離為$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,再根據勾股定理進行解答.
解答 解:(1)H3O+中中心原子O的價層電子對數為3+$\frac{6-1-1×3}{2}$=4,孤電子對數為1,所以空間構型是三角錐形;
H2O中中心原子O的價層電子對數為2+$\frac{6-1×2}{2}$=4,孤電子對數為2,所以空間構型是V形;
NO2+中中心原子N的價層電子對數為2+$\frac{5-1-2×2}{2}$=2,孤電子對數為0,所以空間構型是直線形;
NO2-中中心原子N的價層電子對數為2+$\frac{5+1-2×3}{2}$=3,孤電子對數為1,所以空間構型是V形,
故選:bd;
(2)FeCl3的沸點:319℃,熔點:306℃,熔沸點較低,應屬于分子晶體;
H3PO4、HPO3、H3PO3中P元素化合價依次為+5、+5、+3,H3PO4、HPO3中非羥基氧依次為1、2,元素化合價越高,其酸性越強,非羥基氧越多,酸性越強,故酸性HPO3>H3PO4>H3PO3,
故答案為:分子晶體;HPO3>H3PO4>H3PO3;
(3)原子序數小于36的元素Q和T,在周期表中既處于同一周期又位于同一族,且原子序數T比Q多2,則Q為Fe、T為Ni;
Ni的基態原子外圍電子(價電子)排布式為3d84s2,Fe2+的核外電子排布為1s22s22p63s23p63d6,3d能級有4故未成對電子,
故答案為:3d84s2;4;
(4)由于在NaCl晶體中,每個Na+周圍同時吸引著最近的等距離的6個Cl-,每個Cl-周圍同時吸引著最近的等距離的6個Na+,圖②中符合條件,圖③中選取其中一個離子,然后沿X、Y、Z三軸切割得到6個等距離的且最近的帶相反電荷的離子,所以其配位數也是6,故符合條件,
故選:②③;
(5)[Cu(NH3)4]2+中銅離子與氮原子之間形成配位鍵,氨氣分子中N原子與H原子之間形成極性鍵;
[Cu(NH3)4]2+中的兩個NH3被兩個Cl-取代能得到兩種不同結構的產物,[Cu(NH3)4]2+的空間構型為平面正方形,
故答案為:①③;①;
(6)晶胞中X原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、Y原子數目為8,晶胞的質量為$\frac{4a+8b}{{N}_{A}}$g,晶體密度為ρg/cm3,則晶胞體積為為$\frac{4a+8b}{{N}_{A}}$g÷ρg/cm3,故晶胞棱長x=$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$cm.
Y原子與周圍4個X原子形成正四面體結構,令Y與X之間的距離為y,則正四面體中心到底面中心的距離為$\frac{y}{3}$,正四面體的高為$\frac{4}{3}$y,正四面體棱長=$\frac{\sqrt{2}x}{2}$,則正四面體側面的高為$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$,底面中心到邊的距離為$\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$,故($\frac{4}{3}$y)2+($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$×$\frac{1}{3}$)2=($\frac{\sqrt{2}x}{2}$×$\frac{\sqrt{3}}{2}$)2,整理得y=$\frac{\sqrt{3}}{4}$x,故Y與X的距離為$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$cm,故答案為:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4a+8b}{ρ{N}_{A}}}$.
點評 本題是對物質結構的考查,涉及微粒構型判斷、晶體類型與性質、核外電子排布、化學鍵、晶胞結構與晶胞計算,(6)中計算為易錯點、難點,需要學生具備一定空間想象能力和數學運算能力,難度較大.


科目:高中化學 來源: 題型:選擇題
| 選項 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Fe | H2O(g) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.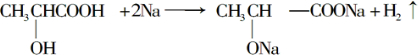 .
.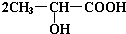 +Na2CO3→
+Na2CO3→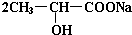 +H2O+CO2↑.
+H2O+CO2↑. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 升高溫度,溶液pH減小 | |
| C. | 稀釋溶液,溶液中所有離子濃度都減小 | |
| D. | 加入Ba(OH)2固體c(CO32-)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 我國菱鎂礦資源豐富、質地優良,是優勢礦產之一,其主要成分是碳酸鎂.某地菱鎂礦中還含有較多的脈石(SiO2)和少量石灰石,利用該菱鎂礦制備硫酸鎂(MgSO4•7H2O),的實驗步驟如下:
我國菱鎂礦資源豐富、質地優良,是優勢礦產之一,其主要成分是碳酸鎂.某地菱鎂礦中還含有較多的脈石(SiO2)和少量石灰石,利用該菱鎂礦制備硫酸鎂(MgSO4•7H2O),的實驗步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 有機高分子化合物稱為聚合物或高聚物,是因為它們大部分是由小分子通過聚合反應而制得的 | |
| B. |  的單體是HOCH2OH與 的單體是HOCH2OH與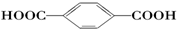 | |
| C. | 聚乙烯( )是由乙烯加聚生成的純凈物 )是由乙烯加聚生成的純凈物 | |
| D. | 高分子材料可分為天然高分子材料和合成高分子材料兩大類 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
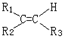 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$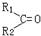 +R3COOH
+R3COOH查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com