
| A. | 非金屬性:F>Cl>Br>I | B. | 單質氧化性:F2>Cl2>Br2>I2 | ||
| C. | 氫化物穩定性:HF>HCl>HBr>HI | D. | 沸點:F2>Cl2>Br2>I2 |
分析 A、鹵族元素中,元素非金屬性隨著原子序數增大而減弱;
B、鹵族元素中,元素非金屬性越強,單質氧化性越強;
C、非金屬的非金屬性越強,其氫化物越穩定;
D.鹵族元素中,相對分子質量越大,沸點越高.
解答 解:、鹵族元素中,元素非金屬性隨著原子序數增大而減弱,即非金屬性:F>Cl>Br>I,故A不選;
B、鹵族元素中,元素非金屬性越強,單質氧化性越強,非金屬性:F>Cl>Br>I,單質氧化性:F2>Cl2>Br2>I2,故B不選;
C、非金屬的非金屬性越強,其氫化物越穩定,非金屬性:F>Cl>Br>I,氫化物穩定性:HF>HCl>HBr>HI,故C不選;
D.鹵族元素中,相對分子質量越大,沸點越高,即沸點:F2<Cl2<Br2<I2,故D選.
故選D.
點評 以鹵族元素為例熟練掌握同一主族元素性質遞變規律,能從物質結構、原子結構知道其產生遞變規律的原因,題目難度不大.


 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:高中化學 來源: 題型:填空題
 ,結構式是F-O-O-O-F.
,結構式是F-O-O-O-F.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ②⑤⑥ | C. | ③ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用銅作電極電解Na2SO4溶液:Cu+2H+$\frac{\underline{\;通電\;}}{\;}$Cu2++H2↑ | |
| B. | NH4Al(SO4)2溶液與過量稀氨水反應:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗試管內壁的銀鏡:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 過量氯氣通入碘化亞鐵溶液中:2Cl2+2Fe3++2I=4Cl-+2Fe3++I2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,化合物中含有離子鍵鍵(填離子或共價)
,化合物中含有離子鍵鍵(填離子或共價)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
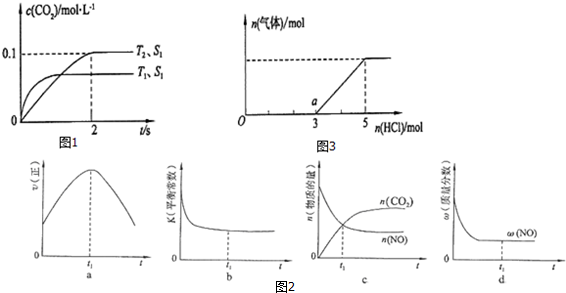
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com