
 、④HCHO,其中碳原子采取sp2雜化的分子有①③④(填物質編號),HCHO分子的立體構型為平面三角形.
、④HCHO,其中碳原子采取sp2雜化的分子有①③④(填物質編號),HCHO分子的立體構型為平面三角形. 分析 (1)同周期隨原子序數(shù)增大,元素第一電離能呈增大趨勢,N元素2p能級為半滿穩(wěn)定狀態(tài),第一電離能高于同周期相鄰元素的;
(2)同周期自左而右電負性增大,同主族自上而下電負性減小;
(3)HF分子之間形成氫鍵,水分子之間形成氫鍵,HF與水分子之間形成2種氫鍵;
(4)Ni的基態(tài)原子核外電子排布式為1s22s22p63s23p63d84s2,CH2=CH2、 、HCHO中碳原子均形成3個σ鍵、沒有孤對電子,雜化軌道數(shù)目為3,而HC≡CH中碳原子均形成2個σ鍵、沒有孤對電子,雜化軌道數(shù)目為2.
、HCHO中碳原子均形成3個σ鍵、沒有孤對電子,雜化軌道數(shù)目為3,而HC≡CH中碳原子均形成2個σ鍵、沒有孤對電子,雜化軌道數(shù)目為2.
解答 解:(1)同周期隨原子序數(shù)增大,元素第一電離能呈增大趨勢,N元素2p能級為半滿穩(wěn)定狀態(tài),第一電離能高于同周期相鄰元素的,故第一電離能:N>O>C,
故答案為:N>O>C;
(2)同周期自左而右電負性增大,同主族自上而下電負性減小,故電負性:N>C>Si,
故答案為:N>C>Si;
(3)HF分子之間形成氫鍵,水分子之間形成氫鍵,HF與水分子之間形成2種氫鍵(H-F…H-O、H-O…H-F),氟化氫水溶液中存在的氫鍵有4種氫鍵,
故答案為:4;
(4)Ni的基態(tài)原子核外電子排布式為1s22s22p63s23p63d84s2,原子有7種能量不同的電子;CH2=CH2、 、HCHO中碳原子均形成3個σ鍵、沒有孤對電子,雜化軌道數(shù)目為3,碳原子采取sp2雜化,HCHO的空間構型為平面三角形,而HC≡CH中碳原子均形成2個σ鍵、沒有孤對電子,雜化軌道數(shù)目為2,碳原子采取sp雜化,
、HCHO中碳原子均形成3個σ鍵、沒有孤對電子,雜化軌道數(shù)目為3,碳原子采取sp2雜化,HCHO的空間構型為平面三角形,而HC≡CH中碳原子均形成2個σ鍵、沒有孤對電子,雜化軌道數(shù)目為2,碳原子采取sp雜化,
故答案為:7;①③④;平面三角形.
點評 本題是對物質結構與性質的考查,涉及電離能、電負性、核外電子排布、雜化方式與空間構型判斷、氫鍵等,注意同周期第一電離能異常情況.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
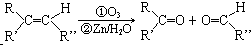

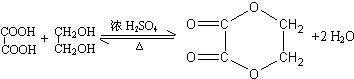 ;分子中有2個羧基、且能使Br2的CCl4溶液褪色的G的同分異構體有HOOC-CH=CH-COOH、
;分子中有2個羧基、且能使Br2的CCl4溶液褪色的G的同分異構體有HOOC-CH=CH-COOH、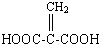 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
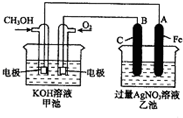 如圖是一個化學過程的示意圖.已知甲池的總反應式為:2CH3OH+3O2+4KOH═2K2CO3+6H2O
如圖是一個化學過程的示意圖.已知甲池的總反應式為:2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
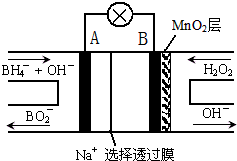 新型NaBH4/H2O2燃料電池(DBFC)的結構如圖所示,該電池總反應方程式:NaBH4+4H2O2═NaBO2+6H2O,有關的說法不正確的是( )
新型NaBH4/H2O2燃料電池(DBFC)的結構如圖所示,該電池總反應方程式:NaBH4+4H2O2═NaBO2+6H2O,有關的說法不正確的是( )| A. | 電極B為正極,納米MnO2層的作用是提高原電池的工作效率 | |
| B. | 放電過程中,Na+從正極區(qū)向負極區(qū)遷移 | |
| C. | 電池負極的電極反應為:BH4-+8OH--8e-═BO2-+6H2O | |
| D. | 在電池反應中,每消耗1L 6mol/L H2O2溶液,理論上流過電路中的電子為12mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 改變催化劑,可改變該反應的活化能 | |
| B. | 該反應為放熱反應,熱效應等于E 1-E 2 | |
| C. | 反應過程 a 有催化劑參與 | |
| D. | 有催化劑條件下,反應的活化能等于 E 1+E 2 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com