
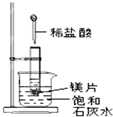
 如圖所示,把試管放入盛有 25℃時飽和石灰水的燒杯中,試管中開始放入幾小塊鎂片,再用滴管滴入 5mL 鹽酸于試管中,試回答下列問題:
如圖所示,把試管放入盛有 25℃時飽和石灰水的燒杯中,試管中開始放入幾小塊鎂片,再用滴管滴入 5mL 鹽酸于試管中,試回答下列問題:分析 鎂與鹽酸反應生成氯化鎂和氫氣,該反應為放熱反應,放出的熱量使燒杯中飽和石灰水溫度升高,氫氧化鈣溶解度隨著溫度升高而降低,反應物總能量高于生成物總能量的反應為放熱反應,據此解答.
解答 解:①鎂與鹽酸反應生成氯化鎂和氫氣,離子方程式為:Mg+2H+=Mg2++H2↑;
故答案為:Mg+2H+=Mg2++H2↑;
②鎂與鹽酸反應生成氯化鎂和氫氣,該反應為放熱反應,放出的熱量使燒杯中飽和石灰水溫度升高,氫氧化鈣溶解度隨著溫度升高而降低,飽和石灰水中會有氫氧化鈣沉淀析出,所以看到的現象為ⅠⅠ.鎂片上有大量氣泡產生;Ⅱ.鎂片逐漸溶解;Ⅲ.燒杯中析出晶體;
故答案為:燒杯中析出晶體;鎂與鹽酸反應產生氫氣,該反應為放熱反應,Ca(OH)2在水中的溶解度隨溫度升高而減小,故析出Ca(OH)2晶體;
③反應物總能量高于生成物總能量的反應為放熱反應,鎂與鹽酸反應產生氫氣,該反應為放熱反應所以MgCl2溶液和H2的總能量小于鎂片和鹽酸的總能量;
故答案為:小于.
點評 本題通過鎂與鹽酸的反應,考查了放熱反應、氫氧化鈣溶解度特點,題目難度不大,注意對基礎知識的積累.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
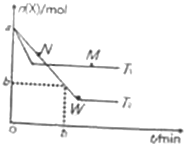 在2L密閉容器中通入amolX氣體并發生反應:2X(g)?Y(g),在T1、T2溫度下,X的物質的量n(X)隨時間t變化的曲線如圖所示.下列敘述不正確的是( )
在2L密閉容器中通入amolX氣體并發生反應:2X(g)?Y(g),在T1、T2溫度下,X的物質的量n(X)隨時間t變化的曲線如圖所示.下列敘述不正確的是( )| A. | 正反應方向為放熱反應 | |
| B. | 在T2溫度下,在0~t1時間內,v(Y)=$\frac{a-b}{{t}_{1}}$mol•(L•min)-1 | |
| C. | M點的正反應速率v(正)大于N點的逆反應速率v(逆) | |
| D. | W點時再加入一定量X,平衡后X的轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | B. | ${\;}_{19}^{40}$ K 和${\;}_{20}^{40}$ Ca | ||
| C. | O2 和 O3 | D. | H2O 和 D2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
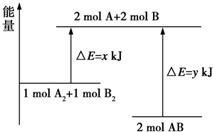
| A. | 該反應過程吸收能量 | |
| B. | 斷裂 1molA-A 鍵和 1molB-B 鍵可放出 x kJ 能量 | |
| C. | 形成 2molA-B 鍵需要放出 y kJ 能量 | |
| D. | 2molAB 的總能量高于 1molA2和 1molB2的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2和S2O32-是氧化劑,Fe2+是還原劑 | |
| B. | 每生成1 mol Fe3O4,則轉移電子數為2 mol | |
| C. | 參加反應的氧化劑與還原劑的物質的量之比為1:1 | |
| D. | 若有2 mol Fe2+被氧化,則被Fe2+還原的O2為0.5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
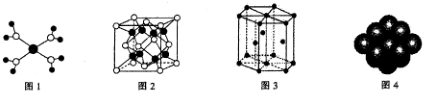
| A. | 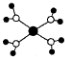 水合銅離子的模型如圖所示,1個水合銅離子中含有4個配位鍵 | |
| B. | 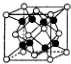 K2O晶體的晶胞如圖所示,每個K2O晶胞平均占有8個O2- | |
| C. | 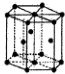 金屬Zn中Zn原子堆積模型如圖所示,空間利用率為68% | |
| D. |  金屬Cu中Cu原子堆積模型如圖,為面心立方最密堆積,每個Cu原子的配位數均為8 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com