
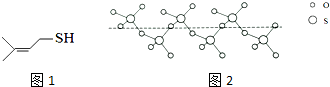
分析 (1)同一周期元素的第一電離能隨著原子序數增大而增大,但第IIA族、第VA族元素第一電離能大于其相鄰元素,據此判斷第一電離能大小順序;
(2)每個共價鍵中均有一個σ鍵,(CH3)2C=CHCH2OH 分子中含有氫鍵,增強分子間作用力;
(3)①SO3中價電子對為3,沒有孤對電子,為平面三角形;而SO2中價電子數為3,孤對電子數為1,為V型,據此進行解答;
②SO3的價電子對為3,沒有孤對電子,為平面三角形;價電子數和原子數分別相等的是等電子體,據此寫出滿足條件的陰離子;圖2中固態SO3中S原子形成4個共價單鍵;
(4)元素X與硒同周期,X元素原子核外未成對電子數最多,則X為24號元素Cr,根據構造原理寫出Cr的基態原子的電子排布式;
(5)單質釙是有金屬鍵形成的晶體,屬于簡單立方堆積,一個晶胞中含有1個原子;如果原子半徑為rpm,則晶胞的邊長是2rpm,根據ρ=$\frac{m}{V}$計算釙晶體的密度的表達式.
解答 解:(1)與O同周期的相鄰元素為N和F,同一周期元素,元素的第一電離能隨著原子序數增大而增大,其中N元素的2p軌道電子處于半充滿狀態,穩定性較強,則第一電離能大小的順序為:F>N>O,
故答案為:F>N>O;
(2)每個單鍵中均有一個σ鍵,雙鍵中含有1個σ鍵,一個3一甲基-2-丁烯硫醇分子中共有15個共價鍵,則1mol 3一MBT中含有σ鏈數目為15NA;(CH3)2C=CHCH2OH 分子間能夠形成氫鍵,增強分子間作用力,使沸點升高,故3-MBT的沸點低于(CH3)2C=CHCH2OH的,
故答案為:15NA;低于;(CH3)2C=CHCH2OH 分子間含有氫鍵,增強分子間作用力,使沸點升高;
(3)①SO3中價電子對為3,沒有孤對電子,為平面三角形,而SO2中價電子數為3,孤對電子數為1,為V型,
A.根據分析可知,二者中心原子的價層電子對數目相等,都是3對,故A正確;
B.二氧化硫是極性分子,而三氧化硫為平面三角形,結構對稱,為非極性分子,故B錯誤;
C.中心原子的孤對電子數目不等,二氧化硫分子中含有1對,三氧化硫不存在孤對電子,故C錯誤;
D.二氧化硫和三氧化硫都含有S與O之間的極性鍵,故D正確;
故答案為:AD;
②SO3分子的空間構型為平面三角形,價電子數和原子數分別相等的是等電子體,則與其互為等電子體的銀離子為NO3-;CO32-;
圖2中固態SO3中S原子形成4個共價單鍵,其雜化軌道類型是sp3,
故答案為:平面三角形;NO3-、CO32-;sp3;
(4)元素X與硒同周期,X元素原子核外未成對電子數最多,則X為24號元素Cr,Cr的基態原子的電子排布式為:1s22s22p63s23p63d54s1,
故答案為:Cr;1s22s22p63s23p63d54s1;
(5)單質釙是有金屬鍵形成的晶體,屬于簡單立方堆積,一個晶胞中含有1個原子,如果原子半徑為rpm,則晶胞的邊長是2rpm,則釙晶體的密度的表達式為:$\frac{M}{{N}_{A}×({2r×1{0}^{-10})}^{3}}$g/cm3=$\frac{1{0}^{30}M}{8{r}^{3}{N}_{A}}$g/cm3,
故答案為:金屬鍵;$\frac{1{0}^{30}M}{8{r}^{3}{N}_{A}}$.
點評 本題考查較為綜合,涉及晶胞計算、物質結構與性質、第一電離能比較、原子雜化軌道判斷等知識,題目濃度較大,注意掌握晶胞結構與應用,(1)為易錯點,注意第IIA族、第VA族元素第一電離能大于其相鄰元素,試題培養了學生的分析、理解能力及靈活應用能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.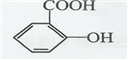 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
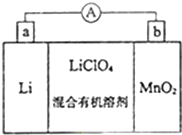 鋰錳電池的體積小,性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,生成LiMnO2.回答下列問題:
鋰錳電池的體積小,性能優良,是常用的一次電池.該電池反應原理如圖所示,其中電解質LiClO4溶于混合有機溶劑中,Li+ 通過電解質遷移入MnO2晶格中,生成LiMnO2.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某酸性工業廢水中含有K2Cr2O7.光照下,草酸(H2C2O4)能將其中的Cr2O72-轉化為Cr3+,草酸被氧化成CO2.某課題組研究發現,少量鐵明礬[Al2Fe(SO4)4•24H2O]即可對該反應起催化作用.為進一步研究有關因素對該反應速率的影響,探究如下:
某酸性工業廢水中含有K2Cr2O7.光照下,草酸(H2C2O4)能將其中的Cr2O72-轉化為Cr3+,草酸被氧化成CO2.某課題組研究發現,少量鐵明礬[Al2Fe(SO4)4•24H2O]即可對該反應起催化作用.為進一步研究有關因素對該反應速率的影響,探究如下:| 實驗編號 | 初始pH | 廢水樣品體積/mL | 草酸溶液體積/mL | 蒸餾水體積/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
| 實驗方案 | 預期實驗結果和結論 |
| 用等物質的量的K2SO4•Al2(SO4)3•24H2O代替實驗①中的鐵明礬,控制其他條件與實驗①相同,進行對比實驗 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| NaOH 溶液體積/mL | 40.00 | 40.00 | 40.00 |
| 樣品質量/g | 7.75 | 15.50 | 23.25 |
| 氨氣質量/g | 1.87 | 1.87 | 1.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子核外電子排布--元素在周期表中的位置 | |
| B. | 分子間作用力的大小--分子穩定性的高低 | |
| C. | 可逆反應向正方向進行的程度--電離常數的大小 | |
| D. | 物質內部儲存的能量--化學反應的熱效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
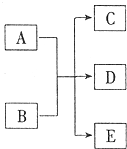 一定條件,物質A~E轉化關系如圖,其中A為單質,常溫下E為無色液體.
一定條件,物質A~E轉化關系如圖,其中A為單質,常溫下E為無色液體.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com