

| A. | 生成等量的CuSO4時,②消耗的酸最少,且能體現綠色化學思想 | |
| B. | 反應⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反應④所得混合氣體X中一定有O2 | |
| D. | 反應①中H2SO4與HNO3物質的量最佳比為3:1 |
分析 A.由Cu原子守恒可知,相同物質的量的Cu最終得到相同的硫酸銅,②中硫酸作酸;
B.反應⑥為氫氧化銅氧化-CHO的反應;
C.反應④中Cu元素的化合價降低,則O元素的化合價必定升高;
D.發生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,以此來解答.
解答 解:A.由Cu原子守恒可知,相同物質的量的Cu最終得到相同的硫酸銅,②中硫酸作酸,①、③中銅和濃硫酸反應會生成二氧化硫氣體污染空氣,消耗酸多,故A正確;
B.葡萄糖與氫氧化銅反應的方程式為:C6H12O6+2Cu(OH)2$\stackrel{△}{→}$C6H12O7+Cu2O+2H2O,所以Y可為葡萄糖或乙醛溶液,故B正確;
C. 硫酸銅分解生成Cu2O,Cu元素的化合價降低,S元素為最高價不能升高,所以O元素的化合價升高,即有氧氣生成,根據2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,所得混合氣體X中一定有O2,故C正確;
D.Cu與混酸反應,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,離子反應為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,從方程式知,硝酸根離子由硝酸提供,氫離子由硝酸和硫酸提供,所以硝酸為2mol時,硫酸為3mol,用混酸中H2SO4與HNO3物質的量之比最好為3:2,故D錯誤;
故選D.
點評 本題考查制備實驗的評價,為高頻考點,把握制備實驗原理、環境保護及發生的反應為解答的關鍵,側重分析與實驗能力的考查,題目難度不大.


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
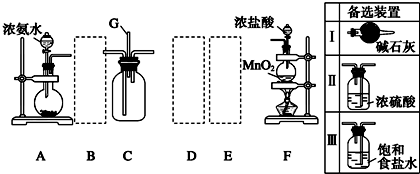
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
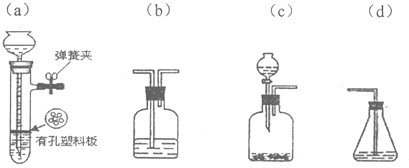
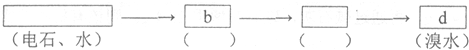
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4種 | B. | 6種 | C. | 7種 | D. | 8種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述各反應均既屬于氧化還原反應,有屬于離子反應 | |
| B. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 | |
| C. | 鹽酸的濃度越大,Cl-的還原性越強 | |
| D. | 每生成1molCl2,上述各反應轉移的電子數均為2NA(NA為阿伏加德羅常數的值) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
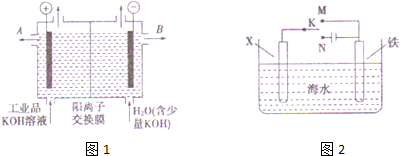
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com