
【題目】(1)下列物質中,既含離子鍵又含共價鍵的化合物是_________;同時存在σ鍵和π鍵的分子是_________,含有極性鍵的非極性分子是_________。
A.N2 B.C2H6 C.CaCl2 D.NH4Cl
(2)用“>”或“<”填空:
晶格能:Na2O_______KCl 酸性:H2SO4_______HClO4 離子半徑:Al3+_______F-
【答案】D A B > < <
【解析】
(1)A.N2分子含有非極性共價鍵,屬于單質,氮氣分子結構簡式為N≡N,所以氮氣分子中含有σ鍵和π鍵的非極性分子;
B.C2H6分子中碳原子和氫原子之間存在極性鍵,碳原子和碳原子之間存在非極性共價鍵,屬于共價化合物,乙烷的結構式為![]() ,乙烷分子中只含σ鍵的非極性分子;
,乙烷分子中只含σ鍵的非極性分子;
C.CaCl2中只含離子鍵,屬于離子化合物;
D.NH4Cl中銨根離子和氯離子之間存在離子鍵,氮原子和氫原子之間存在共價鍵,屬于離子化合物,銨根離子中氮原子和氫原子之間存在σ鍵;
(2)離子化合物中,陰陽離子半徑越小,離子所帶電荷數越多,晶格能越大;非金屬性越強,所對應元素的最高價含氧酸的酸性越強;具有相同電子排布的離子中,原子序數大的離子半徑小。
(1)由分析可知:既含離子鍵又含共價鍵的化合物是NH4Cl;同時存在σ鍵和π鍵的分子是N2;含有極性鍵的非極性分子是C2H6。
(2)Na+的半徑比K+半徑小,O2-的半徑比Cl-半徑小,并且O2-帶的電荷數比Cl-多,故晶格能:Na2O>KCl;
同周期從左向右非金屬性增強,非金屬性S<Cl,對應最高價含氧酸的酸性為H2SO4< HClO4;
具有相同電子排布的離子中,原子序數大的離子半徑小,則離子半徑為Al3+< F-。


 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:高中化學 來源: 題型:
【題目】β—紫羅蘭酮是存在于玫瑰花、番茄等中的一種天然香料,它經多步反應可合成維生素A1。下列說法正確的是( )
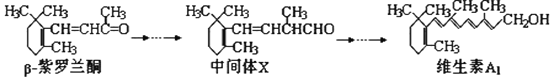
A. β—紫羅蘭酮與中間體X互為同分異構體
B. β—紫羅蘭酮不可使酸性KMnO4溶液褪色
C. 維生素A1易溶于NaOH溶液
D. 1mol維生素A1最多能與5molH2發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)![]() 的名稱為______________________。
的名稱為______________________。
(2)A,B,C三種烴的化學式均為C6H10,它們的分子中均無支鏈或側鏈。
①若A為環狀,則其結構簡式為_________________________________。
②若B為含有雙鍵的鏈狀結構,且分子中不存在“![]() ”基團,則其可能的結構簡式為_______(任寫一種)。
”基團,則其可能的結構簡式為_______(任寫一種)。
③若C為含有三鍵的鏈狀結構,則其可能的結構簡式及名稱為__________。
(3)下列是八種環狀的烴類物質:
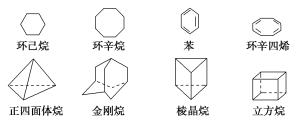
①互為同系物的有________和________(填名稱),互為同分異構體的有________和________,________和________(填寫名稱,可以不填滿,也可以再補充)。
②正四面體烷的二氯取代產物有________種;立方烷的二氯取代產物有________種;金剛烷一氯取代產物有________種。
③寫出與苯互為同系物且一氯代物只有兩種的物質的結構簡式(舉兩例)并用系統命名法命名:___________________________________________。
(4)今有三種化合物結構如下:
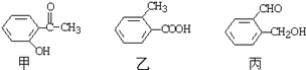
①請寫出丙中含氧官能團的名稱:__________________________________;
②請判斷上述哪些化合物互為同分異構體:_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯的反應裝置如下圖所示,關于實驗操作或敘述錯誤的是

A. 向圓底燒瓶中滴加苯和溴的混合液前需先打開K
B. 實驗中裝置b中的液體逐漸變為淺紅色
C. 裝置c中的碳酸鈉溶液的作用是吸收溴化氫
D. 反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設 NA 為阿伏加德羅常數的值,下列說法正確的是
A.某密閉容器中盛有 0.1molN2 和 0.3molH2,在一定條件下充分反應,轉移電子的數目為 0.6NA
B.常溫下,1L pH=9 的 CH3COONa 溶液中,發生電離的水分子數為 1×109 NA
C.14.0gFe 發生吸氧腐蝕生成 Fe2O3xH2O,電極反應轉移的電子數為 0.5NA
D.標準狀況下,2.24L 丙烷含有的共價鍵數目為 1.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Al、Ti、Co、Cr、Zn 等元素形成的化合物在現代工業中有廣泛的用途。回答下列問題:
(1)下列狀態的鋁中,電離最外層的一個電子所需能量最小的是_____(填標號)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3 時可生成具有揮發性的二聚體 Al2Cl6,二聚體 Al2Cl6 的結構式為_____;(標出配位鍵)其中 Al 的配位數為_________。
(3)與鈦同周期的所有副族元素的基態原子中,最外層電子數與基態鈦原子相同的元素有_____種。
(4)Co2+的價電子排布式_________。NH3 分子與 Co2+結合成配合物[Co(NH3)6]2+,與游離的氨分子相比,其鍵角∠HNH_____(填“較大”,“較小”或“相同”),解釋原因_____。
(5)已知 CrO5 中鉻元素為最高價態,畫出其結構式:_____。
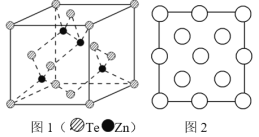
(6)阿伏加德羅常數的測定有多種方法,X 射線衍射法就是其中的一種。通過對碲化鋅晶體的 X 射線衍射圖 象分析,可以得出其晶胞如圖 1 所示,圖 2 是該晶胞沿 z 軸的投影圖,請在圖中圓球上涂“●”標明 Zn 的位置_____。若晶體中 Te 呈立方面心最密堆積方式排列,Te 的半徑為 a pm,晶體的密度為 ρg/cm3,阿伏加德羅常數 NA=_____mol-1(列計算式表達)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學課外興趣小組為了探究影響化學反應速率的因素,做了以下實驗。
(1)用三支試管各取5.0 mL、0.01 mol·L-1的酸性KMnO4溶液,再分別滴入0.1 mol·L-1 H2C2O4溶液,實驗報告如下。

①實驗1、3研究的是_________對反應速率的影響。
②表中V=_________mL。
(2)小組同學在進行(1)中各組實驗時,均發現該反應開始時很慢,一段時間后速率會突然加快。對此該小組的同學展開討論:
①甲同學認為KMnO4與H2C2O4的反應放熱,溫度升高,速率加快。
②乙同學認為隨著反應的進行,因_________,故速率加快。
(3)為比較Fe3+、Cu2+對H2O2分解的催化效果,該小組的同學又分別設計了如圖甲、乙所示的實驗。回答相關問題:

①裝置乙中儀器A的名稱為_________。
②定性如圖甲可通過觀察反應產生氣泡的快慢,定性比較得出結論。有同學提出將CuSO4溶液改為CuCl2溶液更合理,其理由是____________________________________。
③定量如圖乙所示,實驗時以收集到40 mL氣體為準,忽略其他可能影響實驗的因素,實驗中需要測量的數據是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是由4個碳原子結合成的4種有機物(氫原子沒有畫出)

(1)寫出有機物(a)的系統命名法的名稱________。
(2)有機物(a)有一種同分異構體,試寫出其結構簡式________。
(3)上述有機物中與(c)互為同分異構體的是________(填代號)。
(4)任寫一種與(e)互為同系物的有機物的結構簡式________________。
(5)上述有機物中4個碳原子處于同一平面的有________(填代號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合物漿液含Al(OH)3、MnO2和少量Na2Cr2O4。考慮到膠體的吸附作用使Na2Cr2O4不易完全被水浸出,某研究小組利用設計的電解分離裝置(如圖1),使漿液分離成固體混合物和含鉻元素溶液,并回收利用。
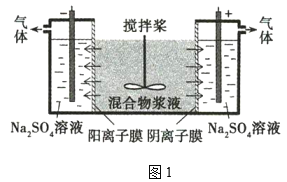
固體混合物的分離和利用的流程圖如圖2所示(流程圖中的部分分離操作和反應條件未標明):
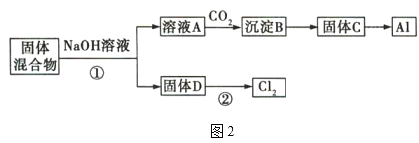
(1)反應①所加試劑NaOH的電子式為___,B→C的反應條件為___,C→Al的制備方法稱為___。
(2)該小組探究反應②發生的條件。D與濃鹽酸混合,不加熱,無變化;加熱有Cl2生成,當反應停止后,固體有剩余,此時滴加硫酸,又產生Cl2。由此判斷影響該反應有效進行的因素有___(填序號)。
a.溫度 b.Cl-的濃度 c.溶液的酸度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com